Учебник Биология - Для учащихся медицинских училищ и колледжей - 2016 год
Белки - Органические вещества - ХИМИЧЕСКАЯ ОРГАНИЗАЦИЯ КЛЕТОК
Белки занимают первое место среди органических веществ, входящих в состав клеток. У животных на них приходится около 50% сухой массы клетки. Их значение и функции в жизнедеятельности чрезвычайно многообразны.
Строение белков. Белки — это биологические непериодические гетерополимеры, мономерами которых являются аминокислоты. Молекулы белков представляют собой неветвящиеся структуры (линейные макромолекулы). Аминокислоты чередуются в молекуле полимера нерегулярным образом. Белки представляют собой самый многочисленный и наиболее разнообразный класс органических соединений клетки (10 — 20%).
Аминокислоты, входящие в состав полипептидов, имеют как минимум одну аминогруппу (-NH2) и карбоксильную группу (-СООН) и различаются структурой и физико-химическими свойствами радикалов (R). В состав природных белков может входить до 20 разновидностей аминокислот. Восемь аминокислот являются незаменимыми, т.е. клетками человека не синтезируются и должны поступать с пищей. Наличие карбоксильной и аминогруппы в составе аминокислот (совмещение свойств кислоты и основания) позволяет им вступать во взаимодействие друг с другом с образованием прочных ковалентных пептидных связей (рис. 6.6). Рост полипептидной цепи происходит с N конца в рибосоме. Аминокислоты, соединяясь друг с другом, образуют различной длины пептиды. Пептиды, содержащие от нескольких аминокислотных остатков до нескольких десятков, существуют в организме в свободной форме и обладают высокой биологической активностью. К ним относят ряд гормонов (окситоцин, адренокортикотропный гормон), некоторые очень токсичные ядовитые вещества (например, аманитин грибов), а также многие антибиотики, производимые микроорганизмами.
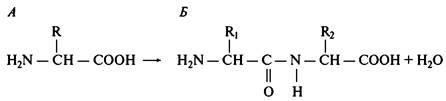
Рис. 6.6. Наличие карбоксильной и аминогруппы в составе аминокислот (А) позволяет им вступать во взаимодействие друг с другом с образованием ковалентных
пептидных связей (Б)
Число аминокислотных остатков в белковых молекулах варьирует в широких пределах (от нескольких сотен до нескольких тысяч). Среди белков организма выделяют простые белки (протеины), состоящие только из аминокислот, и сложные (протеиды), включающие помимо аминокислот так называемые простетические группы различной химической природы (играют важную роль при выполнении белком его биологической функции).
• Липопротеины имеют в своем составе липидный компонент.
• Гликопротеины — углеводный компонент.
• Фосфопротеины имеют одну или несколько фосфатных групп.
• Металлопротеины содержат различные металлы.
• Нуклеопротеины — нуклеиновые кислоты.
Структура белковой молекулы в целом определяется его аминокислотной последовательностью, однако она является довольно лабильной и может зависеть от внешних условий, поэтому более правильно говорить о наиболее энергетически выгодной трехмерной структуре (конформации) белка. Различают первичную, вторичную, третичную и четвертичную структуры белковой молекулы (рис. 6.7).
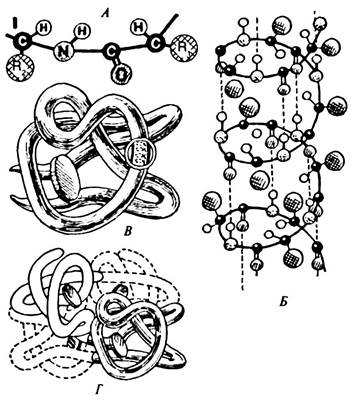
Рис. 6.7. Уровни структурной организации белка:
А — первичная структура белка; Б — вторичная структура (спираль); В — третичная структура; Г— четвертичная структура
Первичная структура образуется в рибосомах, порядок аминокислот задается в соответствии с генетическим кодом (см. параграф 7.3). Она представлена последовательностью аминокислотных остатков в составе полипептидной цепи. Белки отличаются друг от друга прежде всего числом, составом и последовательностью аминокислотных остатков. Однако молекула белка в виде цепи аминокислотных остатков (полипептид) еще не способна выполнять специфические функции. Полипептиды в цитоплазме клеток образуют определенную трехмерную пространственную конфигурацию (конформация белковой молекулы).
Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой.
Вторичная структура возникает в результате образования водородных связей между СО- и NH-группами разных аминокислотных остатков полипептидной цепи и может иметь вид правильной правозакрученной альфа-спирали (глобин) или складчатой (бета-) структуры (кератин волос).
Третичная структура образуется в результате сложной пространственной укладки молекулы белка. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (дисульфидными, ионными, гидрофобными). Формирование третичной структуры осуществляется в несколько стадий с участием особых белков, присоединяющих к себе полипептидную цепочку и создающих условия для укладки ее в трехмерную структуру.
Белки могут иметь глобулярную структуру (глобин) или фибриллярную (миозин) структуру. Биологические функции многие белки выполняют на уровне третичной структуры.
Некоторые белки имеют четвертичную структуру, которая представляет собой сложный комплекс, объединяющий несколько третичных структур (например, белок гемоглобин образован четырьмя глобулами), удерживающихся нековалентными ионными, водородными и гидрофобными связями. Гормон поджелудочной железы — инсулин включает две полипептидные цепи. В состав четвертичной структуры некоторых белков помимо белковых субъединиц включаются и разнообразные небелковые компоненты. Например, гемоглобин содержит сложные гетероциклические соединения, содержащие железо.
Белки обладают рядом физико-химических свойств, вытекающих из их структурной организации:
• это преимущественно водорастворимые молекулы, и, следовательно, они могут проявлять свою функциональную активность только в водных растворах;
• белковые молекулы несут поверхностный заряд, влияющий на проницаемость мембран, каталитическую активность;
• белки проявляют свою активность в определенных температурных условиях.
Неблагоприятные условия среды (химические воздействия, высокая температура, облучение, высокое давление и т.д.) вызывают разрушение структуры молекул белков. Нарушение природной структуры белка, а следовательно, свойств и биологической активности называют денатурацией. Денатурация может быть обратимой и необратимой. В первом случае нарушается четвертичная, третичная или вторичная структура и возможен обратный процесс восстановления — ренатурации, во втором — происходит разрыв пептидных связей в составе первичной структуры.
Функции белков чрезвычайно разнообразны. Они основаны на сложности и многообразии форм и состава самих белков.
Ферментная, или каталитическая. Ферменты увеличивают скорость биохимических реакций в десятки и сотни миллионов раз. Ферменты высокоспецифичны: каждый фермент катализирует определенный тип реакций, в которых участвуют определенные виды молекул субстратов. Специфичность фермента определяется особенностями структуры его активного центра, строго соответствующего структуре одного или нескольких субстратов. В ходе реакции фермент связывает субстрат, последовательно изменяет его конфигурацию, образуя ряд промежуточных молекул, дающих в конечном итоге продукты реакции. Ускоряющее действие катализаторов в различных реакциях связано с энергией активации — той энергией, которую необходимо сообщить реагирующим молекулам в момент их взаимодействия, чтобы реакция стала возможной. Биологические катализаторы и обеспечивают возможность множеству молекул беспрепятственно вступить во взаимодействия. Активность фермента зависит от ряда факторов: температуры и реакции среды, наличия или отсутствия ряда веществ (например, витаминов, служащих коферментами).
Структурная. Белки являются компонентами клеточных мембран и многих органелл, главным компонентом опорных структур организма (кератин, коллаген).
Сократительная. Тубулины, актины, миозины обеспечивают движение клеток и внутриклеточных структур.
Транспортная заключается в присоединении химических элементов (например, кислорода к гемоглобину) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела. Специальные транспортные белки перемещают РНК, синтезированные в клеточном ядре, в цитоплазму. Транспортные белки в составе мембран клеток переносят различные вещества из окружающей среды в цитоплазму, а оттуда — в ядро.
Защитная. Лимфоциты способны синтезировать разнообразные защитные белки — антитела (иммуноглобулины). Их молекулы состоят из четырех полипептидных цепей и имеют участок, узнающий чужеродное вещество и называемый изменчивой областью. Антитела способны распознавать антигены — вещества, несвойственные организму. Антигены могут находиться в крови или в составе вирусов и бактерий. Антитела блокируют антигены, в результате образуется комплекс антиген — антитело, который впоследствии фагоцитируется и разрушается другими формами лейкоцитов. Фибриноген и тромбин защищают организм от кровопотери. Защитную функцию выполняют также антибиотики, синтезируемые некоторыми грибами или бактериями. Эти вещества выделяются в окружающую среду и угнетают процессы жизнедеятельности других организмов — конкурентов. В медицине антибиотики используют для борьбы с инфекционными заболеваниями.
Рецепторная. Молекула рецептора (белок или гликопротеид) специфично реагирует изменением своей пространственной конфигурации на присоединение к ней молекулы определенного химического вещества, передающего внешний регуляторный сигнал, и в свою очередь передает этот сигнал в цитоплазму или ядро. Клетки, принадлежащие к определенному клеточному типу (нервные, мышечные, клетки крови и др.), имеют набор антигенов клеточной поверхности, в состав многих из них входят белки. Такие антигены называют антигенами тканевой принадлежности или тканевой совместимости. Антигены клеточной поверхности демонстрируют принадлежность клетки к тому или иному клеточному типу.
Регуляторная. Специальные белки участвуют в регуляции активности генов, обеспечивая их активацию или репрессию, стимулируют или подавляют клеточное деление, выработку инсулина, гормона роста, соматотропного гормона и др., участвуют в регуляции активности клеток и организма в целом.
Белки, поступающие в составе пищевых продуктов, являются источником аминокислот, высвобождающихся при их расщеплении. Аминокислоты необходимы в реакциях пластического обмена для построения новых белковых молекул. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Однако белки в таком качестве используются редко.
Опорные точки
• Первичная структура белка определяется генотипом.
• Вторичная, третичная и четвертичная структурная организация белков зависит от первичной структуры.
• Все биологические катализаторы — ферменты — имеют белковую природу.
• Белковые молекулы обеспечивают иммунологическую защиту организма от чужеродных веществ.
Вопросы и задания для повторения
1. Какие органические вещества входят в состав клетки?
2. Из каких малых органических соединений состоят белки?
3. Что такое пептиды?
4. Что представляет собой первичная структура белка?
5. Как образуются вторичная, третичная структуры белка?
6. Какой процесс называется денатурацией белка?
7. Перечислите и охарактеризуйте функции белков.