Настольная книга учителя химии 10 класс - поурочные разработки
СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ - ВВЕДЕНИЕ
СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цели урока. Познакомить учащихся с работами предшественников А. М. Бутлерова и дать общее представление об основных положениях его теории. Показать универсальный характер теории строения, т. е. применимость её основных положений для неорганической химии на примере неорганических изомеров и взаимного влияния атомов в молекулах неорганических веществ, назвать основные направления развития теории строения.
Оборудование: модели молекул Стюарта — Бриглеба.
I. Первые теории строения органических соединений
Изучению теории строения органических соединений А. М. Бутлерова предшествует небольшой исторический экскурс, иллюстрирующий состояние химии «природных веществ» в начале XIX в., представления ученых того времени о том, как устроены органические молекулы. Если данный материал не умещается в рамки урока, его можно рассмотреть на заседании химического кружка или предложить ребятам в качестве рефератов.
Трудно себе представить, какой хаос царил в органической химии в начале XIX в. Ученые умели определять качественный и количественный состав веществ, но не имели представления о том, как атомы слагаются в молекулы, не пользовались привычными для нас формулами, не знали валентности, химические реакции описывали словами, а не формулами.
Исторически первой обобщающей теорией в органической химии стала теория этерина1, сформулированная в 20-х гг. XIX в. французским химиком Жаном Батистом Дюма. Он полагал, что этерин является составной частью некоторых более сложных соединений и напоминает в этом отношении неорганическое вещество аммиак:
C2H4 этерин
С2Н4 · НСl хлористый этил
С2Н4 · Н2О этиловый спирт
С2Н4 · H2SО4 этилсерная кислота
NH3 аммиак
NH3 · НСl хлористый аммоний
NH3 · Н2O гидроксид аммония
NH3 · H2SO4 гидросульфат аммония
Значение теории этерина состояло в том, что она впервые позволила рассматривать различные органические вещества с единой точки зрения. Ж. Дюма показал, что состав органических соединений, так же, как и неорганических, подчиняется некоторым закономерностям.
Теория этерина просуществовала недолго. В 1832 г. немецкие ученые Фридрих Велер и Юстус Либих опубликовали статью «Исследование радикала бензойной кислоты», положившей начало новой теории строения - теории радикалов. Термин «радикал» ввел в химию француз Антуан Лоран Лавуазье. Так он называл какую-либо группу атомов, не изменяющуюся в ходе химических реакций.
Вёлер и Либих изучали свойства бензальдегида, вещества, которое в то время называли «горько-миндальное масло». Было установлено, что под действием различных реагентов бензальдегид превращается в новые соединения, причем группа атомов С7Н5О переходит из одного вещества в другое без изменения. Этот радикал ученые назвали бензоилом.
С7Н5ОН бензальдегид
С7Н5ООН бензойная кислота
С7Н5ОСl хлористый бензоил
С7Н5ОВr бромистый бензоил
C7H5ONH2 бензамид
Теория радикалов сразу же была распространена на другие ряды веществ. Берцелиус назвал открытие немецких химиков «началом новой эпохи в растительной химии».
Тем не менее теория радикалов рассматривала строение органических веществ очень поверхностно. На смену ей пришли новые теоретические воззрения, среди которых наиболее заметное место занимала теория типов Огюста Лорана и Шарля Жерара.
Ученые высказали предположение, что все органические вещества можно разделить на четыре типа и рассматривать их как производные неорганических веществ: водорода, хлороводорода, воды и аммиака.

Формулы органических веществ стали записывать «типическими формулами»:
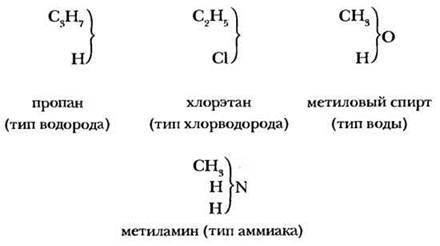
По мере открытия новых органических соединений к четырем типам Жерара добавлялись новые типы, возникло неоднозначное отнесение одних и тех же веществ к тому или иному типу. Сам Жерар считал, что теория типов отражает лишь способность органических веществ вступать в реакции, но не затрагивает их строения. Тем не менее она явилась первым шагом к созданию учения о валентности, без чего было бы невозможно создание теории химического строения.
В середине XIX в. английский ученый Уильям Одлинг предположил, что атомы и радикалы имеют «емкость насыщения», т. е. могут присоединять определенное число других атомов. Эту способность Одлинг предложил обозначать штрихами (Н’, О’’, N’’’, CH3’), а его соотечественник Эдуард Франкленд в 1853 г. ввел термин валентность (от латинского valentia - сила).
Представления о валентности были обобщены и развиты немецким химиком Фридрихом Августом Кекуле. Именно этот ученый впервые сформулировал важнейшие положения органической химии:
— углерод в органических веществах всегда четырехвалентен;
— атомы углерода способны соединяться друг с другом, образуя длинные цепи.
Однако Кекуле вслед за Жераром считал, что формулами можно изобразить лишь химические превращения, а не строение вещества, утверждал, что одно и то же вещество может быть изображено различными формулами.
Постепенное накопление экспериментального материала и попыток его теоретического осмысления подготовило создание первой научной теории строения органических соединений, автором которой явился выдающийся русский химик Александр Михайлович Бутлеров.
II. Теория химического строения А. М. Бутлерова
Учащимся будет интересен один примечательный факт из биографии А. М. Бутлерова. Химия была главным увлечением Саши с раннего детства. Будучи учащимся частного пансиона в Казани, он однажды устроил на кухне оглушительный взрыв. В наказание учителя несколько дней водили его по пансиону с табличкой на груди. На табличке была надпись: «Великий химик». Эти слова оказались пророческими!
Основные положения теории строения можно изложить в свете трех положений, данных в учебнике. В ходе беседы и модельного эксперимента учитель поясняет каждое положение.
1. Необходимо подчеркнуть, что термин «химическое строение» предложен именно Бутлеровым. Под строением (или структурой) он понимал порядок связи атомов в молекуле в соответствии с их валентностью, взаимное расположение атомов. Свойства вещества зависят не только от того, атомы каких элементов и в каком количестве входят в его состав, но и от химического строения молекул. По свойствам вещества можно предположить его структуру, и, наоборот, по химическому строению предсказать свойства.
2. Явление изомерии учащимся знакомо по материалу 9-го класса. Если в кабинете есть набор моделей молекул Стюарта — Бриглеба, можно попросить ребят сделать маленькое открытие. Учитель дает одному из учеников 4 атома углерода и 10 атомов водорода и просит составить из всех этих атомов одну молекулу. Как правило, получается бутан нормального строения. Ученик записывает структурную фор мулу полученной молекулы на доске. Другой ученик получает другое задание: из того же набора атомов составить молекулу, отличающуюся от первой,— и убеждается после долгих попыток, что это можно сделать единственным способом. Учитель отражает развлетвленное строение молекулы с помощью структурной формулы изобутана и закрепляет навык работы с моделями молекул, когда просит учащихся составить возможные изомеры из двух атомов углерода, шести атомов водорода и одного атома кислорода. И в этом случае получаются два изомера - этиловый спирт и простой эфир (диметиловый). По просьбе учителя учащиеся сами дают определение изомеров.
3. Для иллюстрации третьего положения теории химического строения учитель констатирует, что физические свойства изображенных на доске изомеров различаются. В качестве доказательства он может привести температуры кипения:
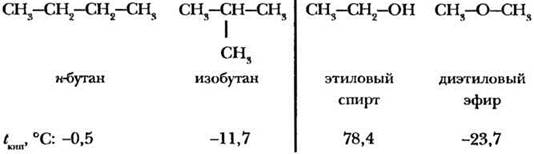
Для какой пары изомеров температуры кипения различаются больше? Для этанола и диметилового эфира различны даже агрегатные состояния! Затем учитель ставит проблему: химические свойства какой пары изомеров различаются в большей степени? Как правило, учащиеся не ошибаются и называют именно вторую пару. Учитель поясняет: окружение атома кислорода во второй паре изомеров различно, один из них имеет связь О—Н, а другой - нет. Для пары бутан — изобутан таких серьезных различий нет, они относятся к одному и тому же классу веществ. Следовательно, заключают учащиеся, абсолютно был прав великий русский химик, когда утверждал, что атомы в молекулах соединений влияют друг на друга.
В молекуле этилового спирта один атом водорода связан через атом кислорода с помощью ковалентной полярной связи, в силу чего этот водородный атом более подвижен, чем атомы, связанные с атомом углерода . В молекуле же диметилового эфира все водородные атомы одинаково связаны с атомом углерода.
В заключение учитель показывает значение теории строения и её универсальный характер, т. е. применимость и для неорганических веществ. Например, явление изомерии (2-е положение), хотя и не столь часто встречается в мире неорганических веществ, однако имеет место и там: изомерны, например тиомочевина (NH2)2CS и роданид аммония NH4CNS, мочевина (NH2)2CO и цианат аммония NH4OCN.
3-е положение теории строения о взаимном влиянии атомов в молекулах также соблюдается для неорганических веществ. Например, это можно заметить, если сравнить между собой свойства гидроксидов элементов одного (например, третьего) периода Периодической системы Д. И. Менделеева:
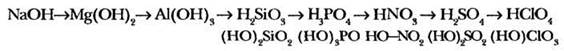
------------------------------------------------------ ------>
щелочь → нерастворимое основание → амфотерный гидроксид → нерастворимая кислота → кислота средней силы → сильная кислота → очень сильная кислота
------------------------------------------------------ ------>
Ослабление основных свойств, т. е. способность диссоциировать с образованием ионов ОН- и усиление кислотных свойств, т. е. способность диссоциировать с образованием ионов Н+.
Учитель поясняет, что все гидроксиды содержат гидроксильную (гидроксо- или окси) группу ОН (отсюда и название этого типа соединений), однако по-разному диссоциируют. Причина этого обусловлена различием влияния атомов и групп атомов друг на друга.
Учитель подчеркивает, что свойства соединений в свете современных представлений определяются не только составом их молекул и химическим строением, но также их пространственным и электронным строением.
1 Этерином в то время называли этилен С2Н4.