Настольная книга учителя химии 10 класс - поурочные разработки
ЖИРЫ: ИХ СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ И РОЛЬ В ПРИРОДЕ - КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Рассмотреть состав, строение и свойства жиров, как группы сложных эфиров. Дать понятие о мылах и сравнить их моющие свойства с аналогичными для синтетических моющих средств.
Оборудование: бензин, растворы KMnО4, NaOH, НО, СаСl2, CuSO4, NaCl, бромная вода, настойка йода, спиртовка, индикаторная бумага, пробирки. Демонстрационные образцы: растительное масло, кусочки твердого жира, сливочное масло, маргарин, мыло, пачка стирального порошка, жидкость для мытья посуды.
I. Открытие состава жиров
Учитель обращается к классу с просьбой дать определение жирам, как сложным эфирам глицерина и жирных карбоновых кислот, а затем сообщает, что путь познания химической природы жиров был непрост. Люди начали использовать жиры в повседневной жизни гораздо раньше, чем задумались об их химическом строении. Животные и растительные жиры являются одним из основных компонентов пищи, их использовали в качестве смазки, косметического средства, топлива для освещения улиц и жилищ.
По уроку «Многоатомные спирты» учащиеся помнят историю открытия глицерина. В 1779 г. уже шведский химик К. Шееле, нагревая оливковое масло с кислотой, получил вязкую желтоватую жидкость, сладкую на вкус. Новое вещество было названо глицерином. Вскоре выяснилось, что глицерин входит в состав всех жиров.
Начало систематических исследований жиров связано с именем французского химика Мишеля Эжена Шевреля. В 1811 г. Шеврель показал, что при гидролизе жиров как животного, так и растительного происхождения образуется глицерин и карбоновые кислоты. Так были открыты восемь неизвестных ранее карбоновых кислот: стеариновая, олеиновая, масляная, капроновая и др. Однако вывод о том, что жиры являются сложными эфирами глицерина и жирных кислот был сделан не Шеврелем, а Жаном Батистом Дюма и Пьером Жозефом Пельтье в 1839 г. Шеврель также отрицал возможность обратного синтеза жиров из продуктов их омыления. Такой процесс был впервые осуществлен Марселеном Бертло в 1854 г.
II. Химическое строение жиров
Учитель обобщает, что только к середине XIX в. было выяснено, что жиры представляют собой сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот (поэтому их называют жирными). Высшие кислоты содержат в молекуле от 10 атомов углерода и более, хотя в составе жиров встречаются и более простые гомологи (масляная, капроновая кислоты).
Молекулы жиров содержат остатки как предельных, так и непредельных кислот, имеющих четное число углеродных атомов и неразветвленный углеродный скелет.

C3H7COOH масляная кислота
C15H31COOH пальмитиновая кислота
C17H35COOH стеариновая кислота
C17H33COOH олеиновая кислота
C17H31COOH линолевая кислота
C17H29COOH линоленовая кислота
Учителю следует обратить внимание на правильность изображения сложноэфирного фрагмента, поскольку в жирах порядок написания остатка спирта и кислоты непривычен. Эту часть молекулы допускается изображать —СН2—О—CO—R или –СН2—ООC—R, в структурном варианте 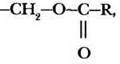 но только не так: —СН2—СОО—R.
но только не так: —СН2—СОО—R.
Природные жиры, как правило, являются смешанными сложными эфирами, т. е. их молекулы образованы различными кислотами.
Жиры не растворимы в воде, но хорошо растворяются в неполярных органических растворителях — бензоле, четыреххлористом углероде, гексане. Физические свойства жиров известны ребятам из повседневной жизни, а также по теме «Органические вещества» из курса 9-го класса. При желании учитель может повторить демонстрационный эксперимент по различной растворимости жиров в воде и, например, бензине, продемонстрировать меньшую плотность жиров по сравнению с водой.
Учитель переходит к рассмотрению химических свойств жиров. Не следует забывать об одном из важнейших таких свойств, определяющих пищевую ценность этих веществ. При расщеплении и окислении жиров в организме выделяется значительное количество энергии, необходимой для протекания жизненно важных эндотермических процессов поддержания постоянной температуры тела.
Учитель демонстрирует горение масляной лампадки, сооруженной из небольшого фитиля, погруженного в растительное масло. До XIX в. для освещения улиц и домов использовали китовый жир или сало. Помимо того что пищевое сырье использовалось для технических целей, это привело к массовому истреблению редких животных. Честь и хвала М. Э. Шеврелю не только как прекрасному химику, но и как изобретателю-рационализатору. Именно он предложил использовать вместо сальных свечей стеариновые. В скором времени стеарин (смесь высших предельных карбоновых кислот) стали получать не из жира, а каталитическим окислением парафина.
Остатки непредельных кислот в жирах сохраняют свойства алкенов. Учитель обращается к классу: какие качественные реакции на алкены вы знаете? В первую очередь, это обесцвечивание бромной воды (реакция присоединения) и раствора перманганата калия (реакция окисления). При добавлении к 2 мл растительного масла равного объема бромной воды или раствора КМnO4 происходит обесцвечивание водного слоя, несмотря на то что масло и вода не смешиваются.
Учащимся профильных классов учитель предлагает написать уравнение реакции триолеата с бромной водой. Для этого необходимо вспомнить, что двойная связь в олеиновой кислоте расположена между 9-м и 10-м атомами углерода в цепи.

Сливочное масло также содержит некоторое количество остатков непредельных кислот. Одним из показателей качества жиров и масел является так называемое йодное число — количество йода в граммах, присоединяющегося к 100 г жира. Качественной реакцией с бромной водой или раствором ода можно отличить натуральное сливочное масло от маргарина. Что же такое маргарин?
Твердые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Учитель предлагает учащимся решить проблемную ситуацию: сравнив молекулярный состав жиров и масел, предложить химический способ получения твердых жиров из жидких. Обычно ребята легко находят правильный ответ. Гидрированием двойных С=С связей в остатках непредельных кислот растительные масла превращают в аналог твердых жиров — саломас. Саломас идет на изготовление маргарина и других продуктов питания.
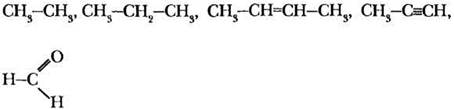
За разработку катализатора процесса гидрирования (в том числе растительных масел) французский ученый Поль Сабатье в 1912 г. был удостоен Нобелевской премии.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к полимеризации. Это свойство используется при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической (оксоль). Натуральную олифу получают полимеризацией масла при повышенной температуре с последующим введением особых добавок, называемых сиккативами. При нанесении на металл, дерево или иную поверхность олифа высыхает с образованием прочных блестящих пленок, не растворимых в воде и органических растворителях. Кроме того, олифу используют для изготовления и разбавления масляных красок.
Одним из важнейших свойств жиров, как и других сложных эфиров, является реакция гидролиза. В незначительной степени гидролиз протекает и при хранении жира под действием влаги, света и тепла. Жир прогорает — приобретает неприятный вкус и запах, обусловленный образующимися кислотами.
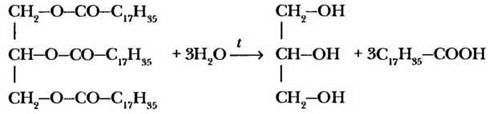
Как и в случае любых других сложных эфиров, ускорить процесс гидролиза и сделать реакцию необратимой можно с помощью раствора щелочи. При нагревании тристеарата с водным раствором гидроксида натрия (можно использовать и карбонаты щелочных металлов) образуются глицерин и стеарат натрия.
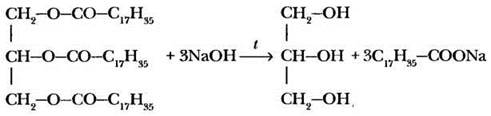
Такой процесс принято называть омылением жира. Почему? Дело в том, что натриевые и калиевые соли высших карбоновых кислот являются мылами.
Мыловарение — один из самых древних химических процессов, стоящих на службе человека. Уже в I в. использовали процесс омыления для получения твердых и жидких мылоподобных продуктов путем кипячения жиров с золой наземных растений (содержащих соли калия) или морских водорослей (содержащих соли натрия).
На уроке в профильном классе или на занятиях в химическом кружке можно провести лабораторную работу по получению мыла и изучению его свойств. В пробирку помещают кусочек (примерно 0,5 г) твердого жира или 0,5 мл растительного масла, добавляют 2-3 мл раствора щелочи и осторожно кипятят 10 мин. Смесь выливают в химический стакан с 20 мл насыщенного раствора хлорида натрия. Мыло собирается на поверхности жидкости в виде серо-белой массы (происходит процесс высаливания). Его собирают деревянной или стеклянной лопаткой, сушат между листами фильтровальной бумаги. В оставшемся растворе можно обнаружить глицерин качественной реакцией с гидроксидом меди (II).
Полученный кусочек мыла растворяют (с помощью стеклянной палочки) в трех пробирках с 2-3 мл воды. Содержимое первой интенсивно встряхивают: получается обильная пена. Это действительно мыло! Во вторую добавляют 2 капли фенолфталеина. Малиновое окрашивание указывает на щелочную реакцию среды. Учитель просит ребят объяснить наблюдаемое явление. (Кто-то наверняка съехидничает, что в мыло попал избыток щелочи от омыления. Это так, но щелочную реакцию имеет и раствор настоящего мыла.) Мыла — это соли, образованные слабой карбоновой кислотой и сильным основанием, они подвергаются гидролизу по аниону R—СОО-. Например, гидролиз стеарата натрия выглядит следующим образом:
![]()
В ту же пробирку учитель добавляет несколько капель соляной кислоты. Малиновая окраска исчезает, на поверхности раствора образуется серо-белая масса. Что это такое? Учащиеся должны объяснить, что соли высших карбоновых кислот вступают в реакции ионного обмена. Реакция идет до конца, поскольку образуется нерастворимая в воде слабая кислота:
![]()
Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO-Na+) и неполярный углеводородный радикал, содержащий 12-18 углеродных атомов. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна). В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко меняется. Неполярные концы молекулы мыла растворяются в каплях масла, полярные карбоксилат-акионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОСТ. Наличие этой оболочки предохраняет частицы от слияния, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира и сала, содержащих грязь, и обусловливает очищающее действие мыла (рис. 32).

Рис. 32. Эмульгирование масла в воде в присутствии мыла
«Мыло душистое» в быту незаменимо. Но и оно не без недостатков. Хозяйственное мыло имеет настолько сильнощелочную реакцию, что им не рекомендуется стирать шерстяные и шелковые вещи, оно сушит и раздражает чувствительную кожу рук и лица. Дорогие сорта туалетного мыла кроме отдушек содержат глицерин, увлажняющие и смягчающие добавки (например, сложные эфиры спермацет, ланолин), они безвредны для кожи, так что не стоит оправдывать элементарное неряшество «токсичностью» средств гигиены. Но у мыла есть более серьезный недостаток: оно плохо мылится в жесткой воде, а при стирке в такой воде белой одежды на ней остается сероватый налет.
Учитель просит ребят вспомнить, в каком случае воду называют жесткой? Если в ней содержатся катионы Са2+ и Mg2+. В такой воде мыло теряет свою моющую способность. Учитель добавляет в третью пробирку с раствором мыла 1-2 мл 5%-ного СаСl2. Кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде. При встряхивании вместо пены образуются хлопья осадка, и мыло расходуется бесполезно.
![]()
Обоих упомянутых выше недостатков лишены синтетические моющие средства (детергенты), представляющие собой натриевые соли высших сульфокислот или алкилбензолсульфокислот. Алкилсульфаты получают сульфированием высших спиртов серной кислотой, а алкилбензолсульфонаты — алкилированием бензолсульфокислоты с? последующей нейтрализацией щелочью:
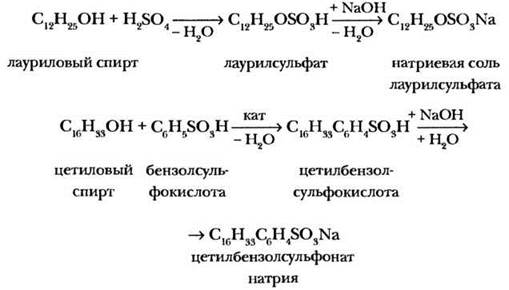
Принцип действия синтетических моющих средств точно такой же, как и у мыла, однако они имеют некоторые преимущества. Во-первых, сульфокислоты являются сильными электролитами, поэтому их натриевые соли не подвергаются гидролизу, и растворы имеют нейтральную, а не щелочную реакцию. Во-вторых, синтетические моющие средства сохраняют свое действие в жесткой и даже морской воде, поскольку их кальциевые и магниевые соли растворимы. Bместе с тем остатки детергентов в сточных водах очень медленно разлагаются биологическим путем и вызывают загрязнение окружающей среды.
Все моющие средства являются поверхностно-активными веществами, т. е. они уменьшают поверхностное натяжение воды. Увидеть этот процесс воочию можно с помощью несложного демонстрационного эксперимента. На поверхность воды, налитой в тарелку, помещают спираль из тетрадной бумаги диаметром 5-6 см (2-2,5 витка). В центр спирали капают одну каплю раствора мыла. Спираль немедленно начинает вращаться. Распространяясь по свободной поверхности воды, мыльный раствор доходит до выхода из спирали и создает небольшую реактивную силу. Если после остановки спирали капнуть еще одну каплю поверхностно-активного вещества, вращение возобновится. Неужели это эффект, создаваемый мылом? А если капнуть в тарелку раствор поваренной соли? Так и есть, вращения не происходит.
Всем известно, что поверхностное натяжение воды способно удержать на поверхности стальную иголку. Иглу несколько раз пропускают между пальцами (она покрывается тончайшей жировой пленкой), кладут на кусочек салфетки или фильтровальной бумаги и вместе с ней опускают на поверхность воды. После того как бумага намокнет, ей осторожно «помогают» утонуть. Игла держится на поверхности воды. Стоит только капнуть в стакан каплю жидкости для мытья посуды, иголка утонет.
Задание 1
1-й уровень
Напишите структурные формулы следующих веществ: а) трипальмитат; б) триолеат; в) диолеостеарат; г) пальмитат натрия; д) стеарат магния.
2-й уровень
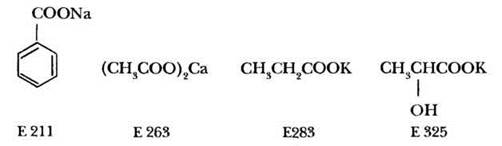
Соли карбоновых кислот широко используются в пищевой промышленности в качестве пищевых добавок. Они выполняют роль консервантов, стабилизаторов, регуляторов кислотности. Назовите соли, формулы и коды которых представлены ниже:
Задание 2
1-й уровень
Какую массу триолеата глицерина необходимо подвергнуть j гидролизу для получения 42,3 г олеиновой кислоты?
2-й уровень
Напишите структурную формулу молекулы жира, образованного глицерином и пальмитиновой, стеариновой и масляной кислотами. Сколько изомеров может иметь такое вещество?
Задание 3
1-й уровень
Какую массу глицерина можно получить из природного жира массой 17,8 кг, содержащего 97% тристеарата глицерина?
2-й уровень
Сколько миллилитров серной кислоты с массовой долей 40% (ρ = 1,4 г/мл) потребуется для получения стеариновой кислоты из 100 г технического мыла, содержащего 70% стеарата натрия.