Химия 11 класс - контрольные и проверочные работы к учебнику О. С. Габриелян - 2016 год
Коррозия металлов. Способы получения металлов. Электролиз. Химические источники тока
ВАРИАНТ 1
Часть А. Тестовые задания с выбором одного правильного ответа
А1. Скорость коррозии железа будет наибольшей при его контакте с
1) никелем .
2) медью
3) цинком .
4) оловом
А2. Коррозия конструкций, изготовленных из сплава железа, будет наибольшей в среде электролита, содержащего
1) кислород в кислой среде при высокой температуре
2) водород в кислой среде при низкой температуре
3) кислород в щелочной среде при низкой температуре
4) водород в щелочной среде при высокой температуре
А3. Какие из утверждений о коррозии металлов верны?
А. Химическая коррозия металлов происходит в проводящей электрический ток среде.
Б. Для протекторной защиты металлической конструкции от коррозии к ней присоединяют кусок менее активного металла.
1) верно только .
2) верно только Б
3) верны оба суждения
4) неверны оба суждения
А4. Восстановлением углем из оксида можно получить оба металла
1) медь и кали.
2) кальций и желез.
3) цинк и олово
4) натрий и барий
А5. Только газообразные продукты выделяются на катоде и аноде при электролизе с инертными электродами водных растворов обеих солей
![]()
A6. При электролизе водного раствора, содержащего хлорид марганца (II), нитрат цинка и бромид меди (II), металлы на катоде будут восстанавливаться в последовательности
1) Сu — Мn — Z.
2) Zn — Мn — Сu
3) Сu — Zn — М.
4) Мn — Zn — Сu
А7. Электролиз водного раствора соли можно использовать для получения обоих металлов
1) хрома и меди.
2) кальция и стронция
3) кобальта и натрия
4) железа и цезия
А8. На графике показана зависимость количества вещества образующихся на электродах продуктов электролиза водного раствора нитрата серебра от времени (рис. 6).
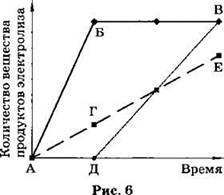
Процессу выделения кислорода на стадии разложения нитрата серебра соответствует участок графика
1) А—Б .
2) Д—В .
3) А—Г .
4) Г—Е
А9. При электролизе водного раствора нитрата ртути (II) с инертными электродами на аноде выделилось 0,224 л (н. у.) газа. Масса металла, выделившегося на катоде, равна
1) 2,01 г
2) 4,02 г
3) 6,03 г
4) 8,04 г
А10. Гальванический элемент состоит из цинкового и медного электродов, погружённых в растворы своих солей. На катоде будет происходить реакция
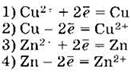
Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3)
В1. Восстановлением водородом из оксида можно получить металлы
1) молибден .
2) железо .
3) калий
4) натрий
5) кальций .
6) медь
В2. Установите соответствие между металлом и способом его электролитического получения.
|
МЕТАЛЛ A) калий Б) кальций B) серебро Г) кадмий |
ЭЛЕКТРОЛИЗ 1) водного раствора солей 2) расплава галогенида 3) водного раствора гидроксида 4) расплава нитрата 5) раствора глинозёма в расплавленном криолите |
В3. Установите соответствие между формулой соли и продуктами, образующимися на катоде при электролизе с инертными электродами её водного раствора.
|
ФОРМУЛА СОЛИ A) CuSO4 Б) FeBr2 B) NiSO4 Г) CsCl |
ПРОДУКТЫ НА КАТОДЕ 1) металл 2) водород 3) оксид серы (IV) 4) металл, водород 5) галоген |
Часть С. Задания с развёрнутым ответом
С1. Составьте схему гальванического элемента, состоящего из серебряного и кадмиевого электродов, погружённых в растворы своих солей. Напишите уравнения реакций катодного и анодного процессов и суммарной реакции, происходящей при работе элемента.
С2. Электролизу с инертными электродами подвергли 10%-й раствор сульфата натрия массой 200 г. Через некоторое время массовая доля соли в растворе составила 15%. Определите объёмы (н. у.) газов, выделившихся на катоде и аноде в процессе электролиза.
ВАРИАНТ 2
Часть А. Тестовые задания с выбором одного правильного ответа
А1. Для защиты железной конструкции от коррозии на ней следует укрепить пластинку из
1) меди
2) магния
3) свинца
4) олова
А2. Процесс химической коррозии железа отражает уравнение реакции
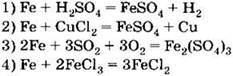
А3. Коррозия детали, изготовленной из цинкового сплава, будет наибольшей при помещении её в воду,
1) насыщенную кислородом
2) содержащую ингибитор
3) насыщенную смесью кислорода и углекислого газа
4) освобождённую от растворённого кислорода
А4. Какие из приведённых утверждений о процессах получения металлов верны?
А. Сущность металлургических процессов заключается в восстановлении ионов металла с помощью различных восстановителей.
Б. Для очистки активных металлов от примесей используют электролиз их водных растворов с растворимым анодом.
1) верно только .
2) верно только Б
3) верны оба суждения
4) неверны оба суждения
А5. При электролизе водного раствора хлорида меди (II) с инертными электродами на аноде происходит процесс
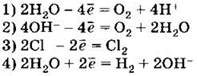
А6. При электролизе водного раствора, содержащего хлорид олова (II), нитрат железа (II) и нитрат серебра, металлы на катоде будут восстанавливаться в последовательности
1) Ag — Fe — S.
2) Fe — Sn — A.
3) Ag — Sn — Fe
4) Fe — Sn — Ag
A7. Электролиз водного раствора соли нельзя использовать для получения обоих металлов
1) меди и хром.
2) лития и бари.
3) железа и натрия
4) серебра и никеля
А8. На графике (рис. 7) показана зависимость количества вещества образующихся на электродах продуктов электролиза водного раствора нитрата серебра от времени.
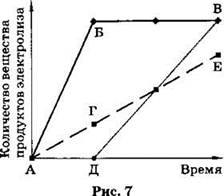
Процессу выделения серебра на стадии электролиза раствора HNO3 соответствует участок графика
1) А—Б .
2) Б—В .
3) Д—В .
4) А—Г
А9. При электролизе водного раствора нитрата калия с инертными электродами на аноде выделилось 25 л (н. у.) газа. Объём газа, выделившегося на катоде, равен при нормальных условиях
1) 25 л .
2) 12,5 л .
3) 50 л .
4) 6,25 л
А10. Гальванический элемент состоит из кадмиевого и цинкового электродов, погружённых в растворы своих солей. На аноде будет происходить реакция
![]()
Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3)
В1. Восстановлением водородом из оксида нельзя получить металлы
1) молибден .
2) вольфрам
3) лити.
4) бари.
5) медь
6) цезий
В2. Установите соответствие между металлом и способом его электролитического получения.
|
МЕТАЛЛ A) медь Б) алюминий B) натрий Г) железо |
ЭЛЕКТРОЛИЗ 1) водного раствора солей 2) расплава галогенида 3) водного раствора гидроксида 4) расплава нитрата 5) раствора глинозёма в расплавленном криолите |
В3. Установите соответствие между формулой соли и продуктами, образующимися на аноде при электролизе с инертными электродами её водного раствора.
|
ФОРМУЛА СОЛИ A) NaF Б) CuBr2 B) MgSO4 Г) CH3COONa |
ПРОДУКТЫ НА АНОДЕ 1) водород 2) кислород 3) оксид углерода (IV) и этан 4) оксид серы (IV) 5) галоген |
Часть С. Задания с развёрнутым ответом
С1. Составьте схему гальванического элемента, состоящего из свинцового и магниевого электродов, погружённых в растворы своих солей. Напишите уравнения реакций катодного и анодного процессов и суммарной реакции, происходящей при работе элемента.
С2. Раствор ацетата натрия массой 200 г подвергли электролизу с инертным анодом до полного разложения соли. Для нейтрализации образовавшейся щёлочи потребовалось 32 мл 20%-го раствора соляной кислоты с плотностью 1,14 г/мл. Определите массовую долю ацетата натрия в исходном растворе.