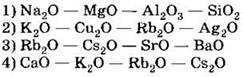Химия 11 класс - контрольные и проверочные работы к учебнику О. С. Габриелян - 2016 год
Периодический закон и Периодическая система химических элементов Д. И. Менделеева
ВАРИАНТ 1
Часть А. Тестовые задания с выбором одного правильного ответа
А1. Число заполняемых энергетических уровней в атоме равно
1) заряду ядра .
2) порядковому номеру
3) номеру периода
4) номеру группы
А2. Атом наиболее активного металла имеет электронную конфигурацию
1) 1s22s22p63s23p64s1
2) 1s22s22p63s1. 3) 1s22s22p63s23p64s2 4) 1s22s22p63s23p63d104s1 А3. В порядке уменьшения электроотрицательности химические элементы расположены в ряду 1) Li — Be — В — Аl 2) N — Р — S — C. 3) В — Аl — Mg — Na 4) Br — S — Cl — О A4. Атом химического элемента, высший оксид которого RO2, имеет электронную конфигурацию 1) 1s22s22p63s2. 2) 1s22s22p63s23p2
3) 1s22s22p63s23p4 4) 1s22s22p63s23p64s1 A5. Химический элемент, атом которого имеет электронную конфигурацию внешнего энергетического уровня 3s23p5, образует летучее водородное соединение 1) РН3
2) H2. 3) НС. 4) НВr А6. В порядке усиления основных свойств оксиды расположены в ряду A7. Наиболее сильные кислотные свойства проявляет 1) Н3РO4 . 2) H2SeO3 3) H2SO4 . 4) H3AsO4 А8. В ряду химических элементов Li → Na → К → Rb 1) ослабевает связь внешних электронов с ядром атома 2) возрастает электроотрицательность 3) уменьшается радиус атомов 4) уменьшаются основные свойства образуемых элементами оксидов А9. В ряду химических элементов Сl → S → P → Si уменьшае(ю)тся 1) число заполняемых энергетических уровней атомов 2) радиус атомов 3) низшая степень окисления атомов 4) кислотные свойства образуемых элементами гидроксидов А10. Какие из утверждений о свойствах химических элементов и их соединений верны? А. Атомы химических элементов, находящихся в одном и том же периоде, характеризуются одинаковым числом валентных электронов. Б. У элементов 3-го периода с увеличением заряда ядра атомов основные свойства образуемых ими высших оксидов и гидроксидов уменьшаются. 1) верно только А 2) верно только Б 3) верны оба суждения 4) неверны оба суждения Часть В. Тестовые задания с выбором трёх правильных ответов (В1 и В2) и на соответствие (В3) В1. У атомов химических элементов 2-го периода слева направо 1) заряд ядер увеличивается 2) число заполняемых электронных энергетических уровней увеличивается 3) радиус уменьшается 4) электроотрицательность увеличивается 5) число электронов на внешнем энергетическом уровне не изменяется 6) прочность связи электронов внешнего уровня с ядром уменьшается В2. Химические элементы фтор и хлор 1) являются неметаллами 2) обладают сходным строением внешнего электронного уровня 3) относятся к d-элементам 4) имеют одинаковое число заполняемых электронных уровней 5) образуют высшие оксиды с формулой R2О7 6) проявляют низшую степень окисления —1 В3. Установите соответствие между формулой летучего водородного соединения химического элемента и формулой его высшего оксида. ФОРМУЛА ЛЕТУЧЕГО ВОДОРОДНОГО СОЕДИНЕНИЯ ФОРМУЛА ВЫСШЕГО ОКСИДА Часть С. Задания с развёрнутым ответом С1. Поясните изменение значений электроотрицательности (ЭО) у элементов 2-го периода. Элемент Li Be В C N O F ЭО 1,0 1,5 2,0 2,5 3,0 3,5 4,0 С2. Химический элемент находится в IV группе Периодической системы. Массовая доля кислорода в его высшем оксиде составляет 40%. Определите этот элемент. Составьте электронную конфигурацию его атомов в невозбуждённом состоянии. К какому электронному семейству принадлежит этот элемент? ВАРИАНТ 2 Часть А. Тестовые задания с выбором одного правильного ответа А1. В порядке уменьшения атомного радиуса химические элементы расположены в ряду 1) Аl — Si — Ge — A. 2) Na — Mg — Al — . 3) Li — Na — К — Ca 4) Se — S — P — Si A2. Атом наименее активного металла имеет электронную конфигурацию 1) 1s22s22p63s23p64s1
2) 1s22s22p63s1. 3) 1s22s22p63s2 4) 1s22s22p63s23p64s2 А3. В порядке усиления электроотрицательности химические элементы расположены в ряду 1) Si — Р — S — О 2) N — Р — Si — Аl 3) As — Р — N — С 4) О — S — Se — As А4. Атом химического элемента, высший оксид которого RO3, имеет электронную конфигурацию 1) 1s22s22p63s23p2
2) 1s22s22p63s23p3
3) 1s22s22p63s23p4 4) 1s22s22p63s23p64s2 A5. Химический элемент, атом которого имеет электронную конфигурацию внешнего энергетического уровня 3s23p2, образует летучее водородное соединение 1) NH3 2) H2S 3) СН4 4) SiH4 А6. Основные свойства высших гидроксидов, образованных химическими элементами, уменьшаются в ряду 1) Са — Sr — Ва — C. 2) Zn — Ca — Mg — Be 3) Sr — Ca — Mg — Be 4) Na — Li — Be — Mg A7. Наиболее сильные кислотные свойства проявляет 1) H2S 2) NH3 3) Н2O 4) H2Se А8. В ряду химических элементов N — Р — As — Sb 1) уменьшается радиус атомов 2) возрастает электроотрицательность 3) ослабевают неметаллические свойства 4) увеличивается число внешних электронов в атомах А9. В ряду химических элементов Ва — Sr — Mg — Be 1) не изменяется число внешних электронов в атомах 2) уменьшается энергия ионизации 3) возрастает высшая степень окисления атомов 4) усиливаются основные свойства образуемых элементами гидроксидов А10. Какие из утверждений о свойствах химических элементов и их соединений верны? А. Высшая степень окисления азота и фосфора в соединениях равна +5. Б. В ряду NaOH — Mg(OH)2— Аl(ОН)3 основные свойства гидроксидов увеличиваются. 1) верно только . 2) верно только Б 3) верны оба суждения 4) неверны оба суждения Часть В. Тестовые задания с выбором трёх правильных ответов (В1 и В2) и на соответствие (В3) В1. У элементов подгруппы углерода с ростом заряда ядра атомов 1) электроотрицательность увеличивается 2) максимальная степень окисления химических элементов уменьшается 3) число заполняемых электронных уровней увеличивается 4) металлические свойства увеличиваются 5) кислотные свойства высших оксидов и гидроксидов уменьшаются 6) устойчивость летучих водородных соединений увеличивается В2. Химические элементы фосфор и сера 1) являются неметаллами 2) имеют одинаковое число заполняемых электронных уровней 3) относятся к s-элементам 4) содержат неспаренные электроны на внешнем уровне 5) имеют более высокие значения электроотрицательности, чем хлор 6) образуют высшие оксиды с основными свойствами В3. Установите соответствие между формулой высшего оксида химического элемента и формулой его летучего водородного соединения. ФОРМУЛА ВЫСШЕГО ОКСИДА A) RO2 Б) R2O5 В) RO3 Г) R2O7 ФОРМУЛА ЛЕТУЧЕГО ВОДОРОДНОГО СОЕДИНЕНИЯ 1) RH3 2) RH4 3) HR 4) H2R Часть С. Задания с развёрнутым ответом С1. Поясните изменение значений радиуса атомов у элементов IA группы. Элемент Li Na К Rb Cs Fr Радиус атома, нм 0,158 0,176 0,216 0,248 0,266 0,29 С2. Химический элемент находится в VI группе Периодической системы. Массовая доля кислорода в его высшем оксиде составляет 37,8%. Определите, какой это элемент. Составьте электронную конфигурацию его атомов в невозбуждённом состоянии. К какому электронному семейству принадлежит этот элемент?