Химия 11 класс - контрольные и проверочные работы к учебнику О. С. Габриелян - 2016 год
Скорость химических реакций. Обратимость химических реакций. Химическое равновесие
ВАРИАНТ 1
Часть А. Тестовые задания с выбором одного правильного ответа
А1. С наибольшей скоростью при обычных условиях протекает реакция
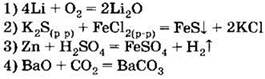
A2. С наименьшей скоростью при комнатной температуре протекает реакция между
1) порошком магния и 5%-м раствором серной кислоты
2) порошком магния и 10% -м раствором серной кислоты
3) стружкой магния и 5%-м раствором серной кислоты
4) стружкой магния и 10%-м раствором серной кислоты
А3. Для увеличения скорости химической реакции
![]()
необходимо
1) увеличить концентрацию водорода
2) ввести в систему ингибитор
3) добавить несколько кусочков цинка
4) увеличить концентрацию кислоты
А4. Скорость реакции гидролиза метилформиата
![]()
не зависит от
1) температуры
2) концентрации метанола
3) добавления воды
4) концентрации метилформиата
А5. Какие из утверждений о скорости химических реакций верны?
A. Скорость реакции ![]() зависит от массы натрия.
зависит от массы натрия.
Б. Скорость реакции ![]() описывается уравнением
описывается уравнением ![]()
1) верно только .
2) верно только Б
3) верны оба суждения
4) неверны оба суждения
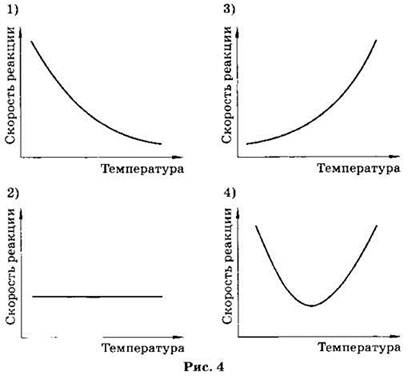
А6. Зависимость скорости химической реакции Н2 + S = H2S от температуры правильно отражает график (рис. 4).
А7. Какие из утверждений о катализаторах верны?
А. Катализаторы не принимают участия в химической реакции.
Б. В присутствии катализатора энергия активации реакции увеличивается.
1) верно только А
2) верно только Б
3) верны оба суждения
4) неверны оба суждения
А8. Скорость элементарной химической реакции
![]()
при повышении концентрации вещества В в 3 раза
1) возрастёт в 3 раза
2) не изменится
3) возрастёт в 9 раз
4) возрастёт в 6 раз
А9. На смещение химического равновесия в системе:
![]()
не оказывает влияния
1) уменьшение концентрации этанола
2) повышение температуры
3) увеличение концентрации этилацетата
4) уменьшение давления
А10. Для константы равновесия обратимой реакции
![]()
справедливо выражение

Часть В. Тестовые задания с выбором трёх правильных ответов (В1 и В2) и расчётная задача (В3)
В1. Химическое равновесие можно сместить в сторону продуктов реакции при одновременном уменьшении давления и увеличении температуры в системах
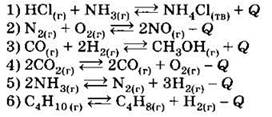
В2. Для системы ![]() справедливы утверждения
справедливы утверждения
1) скорость прямой реакции возрастает при добавлении углерода
2) измельчение углерода не оказывает влияния на скорость обратной реакции
3) для смещения равновесия в сторону исходных веществ необходимо увеличить концентрацию оксида углерода (II)
4) введение катализатора смещает равновесие в сторону продукта реакции
5) повышение давления не оказывает влияния на смещение равновесия
6) при уменьшении температуры равновесие смещается в сторону исходных веществ
В3. Температурный коэффициент реакции равен 4. На сколько градусов необходимо понизить температуру, чтобы скорость реакции уменьшилась в 64 раза?
Часть С. Задания с развёрнутым ответом
С1. В реакции А + В = D начальные концентрации веществ А и В равны соответственно 5 моль/л и 4 моль/л. При концентрации вещества А 3 моль/л скорость реакции равна 1,8 ∙ 10-2 моль/(л ∙ с). Определите: а) константу скорости реакции; б) скорость реакции при концентрации вещества В 0,5 моль/л.
С2. При некоторой температуре равновесие реакции ![]() устанавливается при следующих равновесных концентрациях: [А] = 0,01 моль/л, [В] = 0 ,4 моль/л, [С] = 0,04 моль/л. Определите: а) константу равновесия реакции; б) начальные концентрации исходных веществ, если исходные концентрации продуктов реакции равны нулю.
устанавливается при следующих равновесных концентрациях: [А] = 0,01 моль/л, [В] = 0 ,4 моль/л, [С] = 0,04 моль/л. Определите: а) константу равновесия реакции; б) начальные концентрации исходных веществ, если исходные концентрации продуктов реакции равны нулю.
ВАРИАНТ 2
Часть А. Тестовые задания с выбором одного правильного ответа
А1. С наибольшей скоростью при комнатной температуре разбавленная серная кислота взаимодействует с
1) магнием
2) железом
3) цинком
4) оловом
А2. Скорость реакции будет наибольшей при взаимодействии
1) мрамора с раствором соляной кислоты
2) магния с раствором серной кислоты
3) углекислого газа с известковой водой
4) раствора сульфата натрия с раствором нитрата бария
А3. Для увеличения скорости химической реакции
![]()
необходимо
1) добавить углерод
2) увеличить концентрацию оксида углерода (II)
3) повысить температуру
4) понизить температуру
А4. Скорость реакции гидролиза этилформиата
![]()
не зависит от
1) температуры
2) концентрации муравьиной кислоты
3) добавления воды
4) концентрации этилформиата
А5. Какие из утверждений о скорости химических реакций верны?
А. Скорость реакции СаСO3 = СаО + СO2 уменьшается при добавлении углекислого газа.
Б. Скорость реакции MgO + 2НСl = MgCl2 + Н2O возрастает при увеличении концентрации кислоты.
1) верно только .
2) верно только .
3) верны оба суждения
4) неверны оба суждения
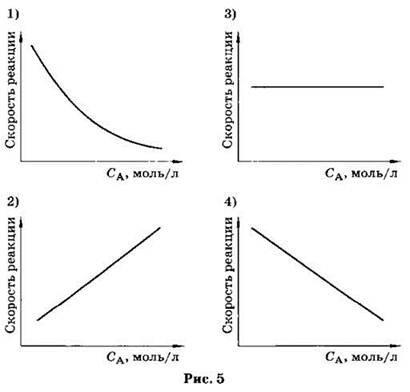
А6. Зависимость скорости элементарной реакции А(г) + В(тв) = D(тв) ОТ концентрации вещества А правильно отражает график (рис. 5).
А7. Скорость реакции ![]()
1) увеличивается при добавлении хлорида фосфора (V)
2) не зависит от температуры
3) уменьшается при увеличении концентрации хлора
4) возрастает при увеличении давления в системе
А8. Для возрастания скорости элементарной химической реакции А(тв) + 2В(г) = 2D(r) в 9 раз необходимо увеличить концентрацию вещества
1) А в 9 раз .
2) В в 9 раз
3) В в 3 раза.
4) D в 3 раза
А9. В системе
![]()
смещению химического равновесия в сторону образования сложного эфира будет способствовать
1) введение катализатора
2) увеличение давления
3) уменьшение концентрации метилацетата
4) уменьшение концентрации метанола
А10. Для константы равновесия обратимой реакции ![]() справедливо выражение
справедливо выражение
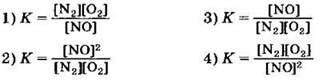
Часть В. Тестовые задания с выбором трёх правильных ответов (В1 и В2) и расчётная задача (В3)
В1. Химическое равновесие можно сместить в сторону продуктов реакции при одновременном уменьшении давления и увеличении температуры в системах
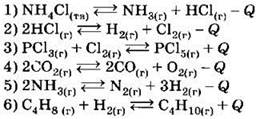
В2. Для системы ![]() справедливы утверждения
справедливы утверждения
1) скорость образования метанола возрастает при повышении давления
2) увеличение концентрации водорода не оказывает влияния на скорость прямой реакции
3) для смещения равновесия в сторону исходных веществ необходимо увеличить концентрацию метанола
4) введение катализатора смещает равновесие в сторону продукта реакции
5) повышение давления смещает равновесие в сторону образования метанола
6) при уменьшении температуры равновесие смещается в сторону исходных веществ
В3. При температуре 40 °С реакция протекает за 25 с, а при температуре 60 °С — за 4 с. Определите температурный коэффициент реакции.
Часть С. Задания с развёрнутым ответом
С1. В реакции А + 2В = D начальные концентрации веществ А и В равны соответственно 3 моль/л и 4 моль/л. При концентрации вещества А 2 моль/л скорость реакции равна 1,6 ∙ 10-3 моль/(л ∙ с). Определите: а) константу скорости реакции; б) скорость реакции при концентрации вещества В 1 моль/л.
С2. При некоторой температуре равновесие реакции ![]() устанавливается при следующих равновесных концентрациях: [А] = 0,2 моль/л, [В] = 0,1 моль/л, [D] = 0,05 моль/л. Определите: а) константу равновесия реакции; б) начальные концентрации исходных веществ, если исходная концентрация продукта реакции равна нулю.
устанавливается при следующих равновесных концентрациях: [А] = 0,2 моль/л, [В] = 0,1 моль/л, [D] = 0,05 моль/л. Определите: а) константу равновесия реакции; б) начальные концентрации исходных веществ, если исходная концентрация продукта реакции равна нулю.