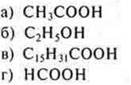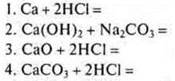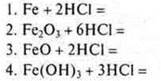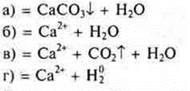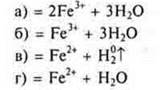Поурочные разработки по химии 11 класс
Органические и неорганические основания - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: закрепить знания о классификации, номенклатуре, физических и химических свойствах, строении оснований: органических и неорганических; химических свойствах оснований: научить правильно составлять уравнения реакций, подтверждающие химические свойства оснований; обобщить и закрепить положения теории строения органических соединений о взаимном влиянии атомов и групп атомов.
Основные понятия: основание, донор, акцептор, протолитическая теория и электронная теория оснований, взаимное влияние атомов и групп атомов в органических соединениях.
Оборудование: набор реактивов, NH3 · H2O, пробирки, держатель для пробирок, спиртовка, СаСO3, газоотводная трубка.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
II. Самостоятельная работа
|
Вариант I |
Вариант II |
|
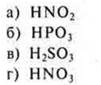
1. Кислотные свойства наиболее ярко выражены у вещества: |
|
|
|
|
|
2. Ионное уравнение реакции |
|
|
|
|
|
соответствует взаимодействию: |
|
|
а) гидроксида калия и азотной кислоты б) гидроксида бария и серной кислоты в) гидроксида лития и хлорида бария г) аммиака и бром водородной кислоты |
а) карбоната натрия и уксусной кислоты б) карбоната кальция и азотной кислоты в) гидрокарбоната кальция и соляной кислоты г) карбоната бария и муравьиной кислоты |
|
3. Формулы продуктов взаимодействия концентрированной серной кислоты с |
|
|
серебром: а) Н2 и Ag2SO4 б) SO2, Н2O и Ag2SO4 в) H2S, Н2O4 и Ag2SO4 г) реакция не идет |
магнием: а) реакция не идет б) H2S, Н2O, MgSO4 в) SO2, Н2O, MgSO4 г) Н2, MgSO4 |
|
4. Установите соответствие: левая часть молекулярного уравнения: |
|
|
|
|
|
правая часть ионного уравнения: |
|
|
|
|
|
Задание со свободным ответом 5. Составьте уравнения реакций, подтверждающие свойства |
|
|
азотной кислоты |
серной кислоты |
|
6. Выведите формулу кислоты |
|
|
|
|
Ответы на вопросы самостоятельной работы
Вариант I
1. г.
2. а.
3. б.
4. 1—г; 2— а; 3—б; 4 —в.
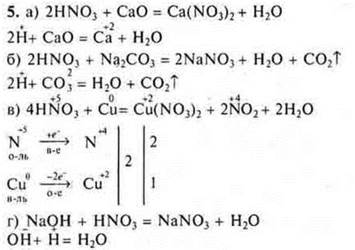
6. Задача
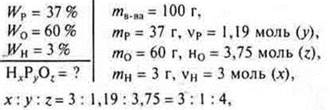
Н3РО4 — фосфорная кислота.
Вариант II
1. г.
2. а.
3. б.
4. 1—в; 2—а; 3—г; 4—в.
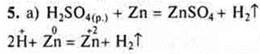
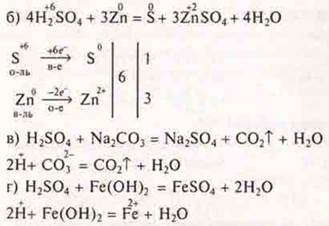
6. Задача
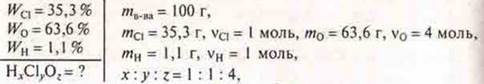
НСlO4 — хлорная кислота.
III. Проверка правильности выполнения домашнего задания
В момент выполнения теста учитель проверяет выполнение домашнего задания в рабочих тетрадях у некоторых учащихся.
Ответы на вопросы домашнего задания
§ 20, № 3
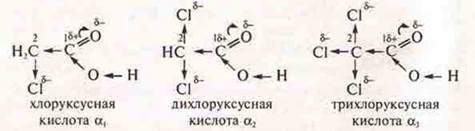
α3 > α2> α1; в молекуле трихлоруксусной кислоты δ+ углерода № 1 увеличивается в результате смешения электронной плотности по π-связи в сторону кислорода и смешения электронной плотности к более электроотрицательным атомам хлора: в трихлоруксусной — к трем атомам хлора, в монохлоруксусной — к одному атому хлора, что вызывает наибольшее смещение δ- от атома кислорода в группе —ОН, обеспечивая подвижность протона в группе —ОН и легкую диссоциацию кислот, особенно в трихлоруксусной кислоте.
§ 20 № 5
![]()
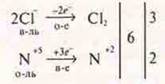
§ 20 № 6
![]()
HF — молекула прочнее HCl, т. к. атом F имеет радиус атома меньше атома Сl, а ЭОF > ЭОCl. Чем больше разность в ЭО, тем полярнее связь, прочнее молекула.
Кислота HCl сильнее HF, т. к. радиус иона Cl больше радиуса нона F-, а также заряд ядра Cl+17, a F+9. С наибольшей силой происходит отталкивание протона в молекуле HCl, и диссоциация идет легко.
αНСl > αHF между молекулами HF очень полярными и молекулами воды — полярными, образуются водородные связи
![]() что затрудняет диссоциацию HF.
что затрудняет диссоциацию HF.
Задача 9

IV. Изучение нового материала
План изложения
1. Определение оснований, классификация, номенклатура, химическая связь, тип кристаллической решетки.
2. Протолитическая и электронная природа кислотно-основных свойств оснований.
3. Химические свойства оснований неорганических и органических в свете теории электролитической диссоциации:
а) действие на индикаторы;
б) взаимодействие с кислотами, солями, оксидами.
Учитель предлагает учащимся в рабочих тетрадях отыскать записи, связанные с классификацией веществ. Найти определение оснований и классификацию их.
Общая формула оснований: ![]()
Основания — сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидроксогруппами.
Пример:
Fe(OH)3 — гидроксид железа(III); NaOH — гидроксид натрия.
Основания бывают растворимые — щелочи, малорастворимые и нерастворимые. Однако в таблице 19 с. 252 учебника дается более основательная классификация оснований, которую нам необходимо знать.
Пример:
Fe(OH)3 — гидроксид железа (III), кислородсодержащее, трехкислотное, нерастворимое, слабое α → 0, нелетучее, нестабильное.
NaOH — гидроксид натрия, кислородсодержащее, однокислотное, растворимое, сильное, α → 1, нелетучее, стабильное.
СН3—NH2 — органическое основание метиламин, бескислородное, однокислотное, растворимое, слабое, α → 0, летучее, стабильное.
С точки зрения теории электролитической диссоциации основания — это электролиты, в водных растворах которых в качестве аниона присутствует анион гидроксогруппы: ![]()
В свете протолитической теории Бренстеда-Лоури основания — это молекулы или ионы, которые служат акцепторами протонов. Согласно электронной теории Г. Н. Льюиса, основания — те реагенты, которые выступают донорами электронной пары.
Пример:
NH3 — аммиак, у атома азота имеется неподеленная электронная пара, следовательно :NH3 выступает донором, т.е. основанием.
У органических оснований — аминов, в аминогруппе — ![]() у атома азота имеется неподеленная пара электронов, следовательно, амины — органические основания.
у атома азота имеется неподеленная пара электронов, следовательно, амины — органические основания.
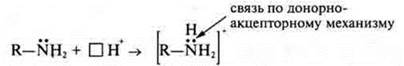
Если рассматривать неорганические основания, то химическая связь в молекуле основания между катионом металла и гидроксогруппой — ионная, а в гидроксогруппе — ковалентная-полярная. Кристаллическая решетка но типу может быть и ионной и молекулярной.
Химические свойства неорганических оснований
Растворимые неорганические основания диссоциируют:
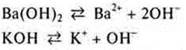
Анион гидроксогруппы вызывает изменение цвета индикаторов:
фенолфталеин — малиновый цвет;
синий лакмус — не изменяется;
метилоранж — желтый;
универсальный индикатор — до синего цвета.
Взаимодействие растворимых и нерастворимых оснований с кислотами
Эксперимент проводит учитель, учащиеся самостоятельно записывают уравнения реакций на доске и в тетрадях.
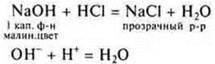
Эксперимент:
![]()
При недостатке НСl образуется основная соль.
![]()
Взаимодействие растворимых оснований с кислотными оксидами
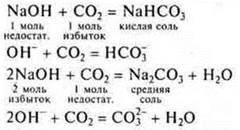
Эксперимент:
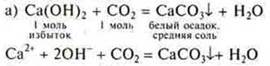
Пропускаем СO2 до исчезновения осадка
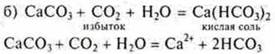
![]()
При проведении этого эксперимента необходимо еще раз объяснить учащимся понятия «избыток» и «недостаток» при образовании разных солей многоосновных кислот. Это необходимо знать дня решения расчетных задач.
Взаимодействие растворимых оснований с солями
Эксперимент:
![]()
Взаимодействие растворимых оснований с амфотерными оксидами и амфотерными основаниями
Продукты образуются разные: все зависит от условий.
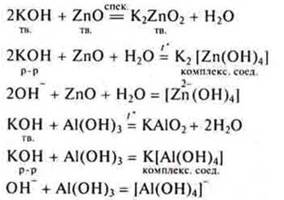
Взаимодействие растворимых и нерастворимых оснований с органическими веществами
![]()
Разложение нерастворимых оснований при нагревании
Эксперимент:
![]()
В качестве обобщения можно составить схему:

При определенных условиях нерастворимое основание взаимодействует с кислотными оксидами, всегда взаимодействует с кислотами.
Органические основания — амины, гетероциклические соединения. В состав аминов входит аминогруппа, которая обеспечивает основные свойства органических соединений. По свойствам они сходны с аммиаком, но как основания амины предельного ряда сильнее.
Сравним основной характер аммиака и метиламина.
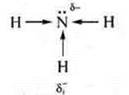 У аммиака δ- атома азота возрастает за счет смещения электронной плотности от трех атомов водорода.
У аммиака δ- атома азота возрастает за счет смещения электронной плотности от трех атомов водорода.
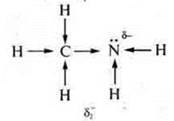 У метиламина δ- атома азота возрастает не только за счет электронной плотности атомов водорода, но и радикала —СН3. δ2- > δ1-
У метиламина δ- атома азота возрастает не только за счет электронной плотности атомов водорода, но и радикала —СН3. δ2- > δ1-
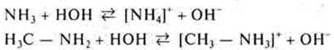
Ароматические амины обладают более слабыми основными свойствами. Ароматическое кольцо, π-электронное облако (6e-) вступает в сопряжение с неподеленной парой электронов атома азота в группе —NH2, уменьшая тем самым δ- атома азота, протонирование ослабевает. В ароматическом кольце происходит перераспределение плотности. Наибольшая электронная плотность у атомов углерода в положениях 2, 4, 6.
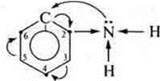
В этих положениях будет легко проходить реакция замещения. Это объясняется взаимным влиянием атомов и групп атомов в органических соединениях (положение теории химического строения А. М. Бутлерова).
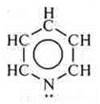 — гетероциклическое соединение пиридин является основанием.
— гетероциклическое соединение пиридин является основанием.
Многие гетероциклические соединения более сложного состава являются основой азотистых оснований: тимин, аденин, гуанин, цитозин, которые являются основой ДНК, РНК.
Во многих лекарственных препаратах присутствуют производные ароматических аминов.
V. Домашнее задание
1) § 21, № 2, 3, 4, 5.
2) Составить уравнения реакций, подтверждающие основные свойства:
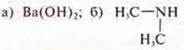
Сделать домашнее задание на отдельном листке, на оценку.
VI. Закрепление
§ 21, № 1.
1) фенол-кислота
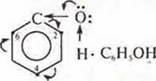 Подвижность атома водорода в группе —ОН объясняется следующим:
Подвижность атома водорода в группе —ОН объясняется следующим:
а) неподеленная пара электронов атома кислорода группы —ОН вступает в сопряжение с 6е- π-облаком ароматического кольца;
б) атом кислорода, группы —ОН, теряя электронную плотность, смешает в свою сторону связь с водородом, обеспечивая ему подвижность:
в) в ароматическом кольце происходит перераспределение электронной плотности. Наибольшая приобретается атомами С в положениях 2, 4, 6. Это обеспечивает легкое замещение атомов водорода.
Амино-группа —NH2 оказывает точно такое же влияние на ароматическое кольцо в фенил-амине 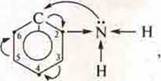 вследствие чего замещение водорода в положениях углерода 2, 4, 6 идет легко, а сам амин становится слабым органическим основанием.
вследствие чего замещение водорода в положениях углерода 2, 4, 6 идет легко, а сам амин становится слабым органическим основанием.
Общее влияние —ОН в феноле и —NH2 в амине на ароматическое кольцо — это изменение электронной плотности в кольце, и приобретение ее наибольшей в положениях атомов углерода 2, 4, 6.
—ОН и —NH2 — это ориентанты I рода.
Согласно теории строения органических соединений А. М. Бутлерова свойства веществ зависят не только от того, какие атомы и сколько их входят в состав молекулы, но и оттого, как они между собой соединены и взаимно влияют друг на друга.