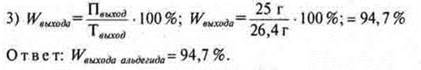Поурочные разработки по химии 11 класс
Урок обобщающего повторения по теме «Вещества и их свойства» - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить и закрепить узловые вопросы темы, все понятия, научить обоснованно объяснять классификацию, химические свойства изученных классов веществ, правильно составлять уравнения реакций по схемам превращений, применять знания в решении расчетных задач.
Оборудование: тесты-задания на каждый стол.
Рекомендации учителю: в гесте даются разноуровневые задания. Учитель предлагает учащимся задания по выбору, но по каждому изученному вопросу темы.
Ход урока
I. Организационный момент
Постановка целей и задач урока. Организация учащихся на работу с целью подготовки к контрольной работе № 4 (парная работа).
II. Выполнение заданий теста, обсуждение правильных ответов
Вопросы теста
1. Классификация веществ:
а) распределить по классам неорганических соединений вещества:
Сr(ОН)3, НСlO4, НВr, NaH2PO4, SO2, (CuOH)2CO3, Cu2O, К[Аl(ОН)4]. Назвать их.
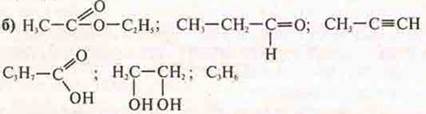
Указать классы соединений органических веществ и назвать их.
2. Металлы:
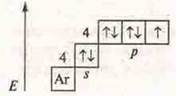
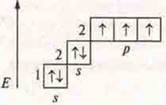
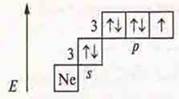
а) Составить электронные и графические формулы атомов: Zn, Na, Мn; определить С.О. Составить формулы высшего оксида и гидроксида, указать их характер.
б) Пользуясь электрохимическим рядом напряжений металлов, привести не менее двух примеров реакций, характеризующих химические свойства металлов и их соединений:
![]()
3. Неметаллы:
а) Составить электронные формулы атомов брома, азота, серы. Записать формулы водородного соединения, высшего оксида и гидроксида.
б) Определить, как изменяется кислотный характер оксидов в ряду
SO3 - Р2O5 - SiO2 - Н2O
Дать обоснованный ответ.
в) Показать, как изменяется прочность связи (энергия разрыва) в ряду веществ
Н2O - H2S – H2Se - Н2Те
Ответ поясните.
4. Кислоты органические и неорганические:
а) С какими из предложенных веществ будет взаимодействовать серная кислота (разб.)? Составить уравнения реакций в молекулярном и ионном виде: Сu, FeO, SO2, Сu(ОН)2, ВаСl2, Na2S.
б) Расположить бромоводородную, йодоводородную, хлороводороную, фтороводородную кислоты в порядке усиления их кислотных свойств. Ответ пояснить.
в) Рассмотреть взаимное влияние атомов в молекулах метановой и этановой кислот. Какая кислота сильнее? Ответ поясните.
5. Основания органические и неорганические:
а) Как изменяются свойства летучих водородных соединений элементов V группы главной подгруппы ПСХЭ с увеличением порядкового номера? Дать обоснованный ответ.
б) Взаимодействие каких веществ соответствует кратким ионным уравнениям:
![]()
в) Как изменяются основные свойства летучих водородных соединений элементов II периода ПСХЭ с увеличением порядкового номера? Дать обоснованный ответ.
6. Амфотерные соединения:
а) будет ли изменять окраску синего лакмуса в аминоуксусной кислоте? Ответ обосновать.
б) составить формулы оксидов и гидроксидов следующих катионов и указать их характер: Сr2+, Сr3+, Сr6+.
в) при осторожном приливании к раствору сульфата цинка раствора гидроксида калия сначала образуется осадок, который растворяется при добавлении избытка щелочи. Ответ пояснить. Составить уравнения химических реакций.
7. Генетическая связь неорганических соединений:
а) Из веществ, формулы которых S, Сu, SO2, H2SO4, BaSO4, SO3, Na2SO3, составить генетический ряд (полный), записать уравнения реакций.
б) Из веществ, формулы которых СuO, Сu, NO2, Сu(ОН)2, СuСl2, НСl, составить генетический ряд (полный), записать уравнения реакций.
в) Написать уравнения реакций, согласно схемам превращений:
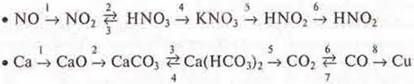
8. Генетическая связь органических соединений.
а) Из веществ, формулы которых
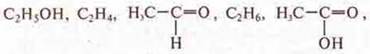
составить генетический ряд и уравнения химических реакций всех превращений.
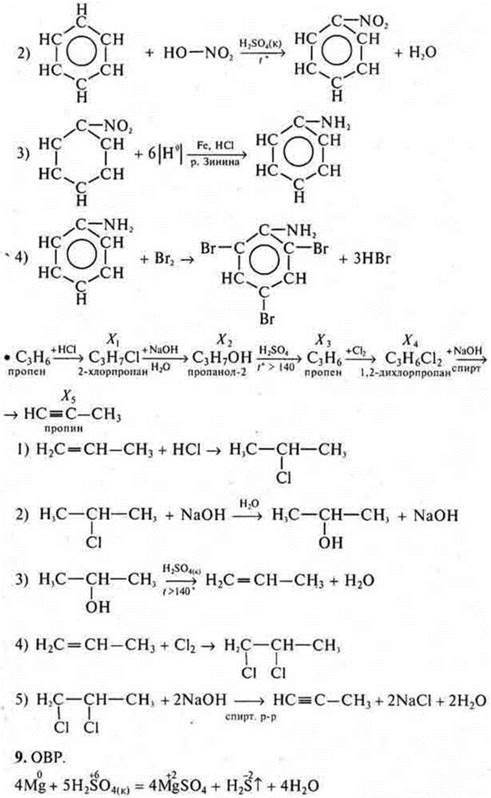
б) Составить уравнения реакций согласно схемам превращений:
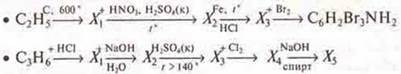
Дать названия всем веществам.
9. Окислительно-восстановительные реакции:
а) Составить ОВР между Mg и H2SO4(к); HNО3(к), HNО3(p.).
б) Дать определения:
• восстановитель — это...
• окислитель — это...
в) Определить С.О. элементов в соединениях и ответить на вопрос: в качестве окислителя или восстановителя или того и другого в зависимости от условий они выступают: К2Сr2O7; К2МnO4; NH3.
г) составить ОВР:
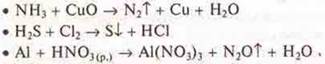
10. Расчетные задачи:
а) Задачи на выведение формул соединения.
• При сгорании органического вещества массой 2,52 г образовалось 7,92 г оксида углерода (IV) и 3,24 г воды. Плотность паров этого вещества по воздуху равна 2,9. Выведите молекулярную формулу этого органического вещества.
• Выведите молекулярную формулу фторопроизводного предельного углеводорода с массовой долей фтора 73 %, углерода 23 % и водорода 4%. Относительная молекулярная масса этого соединения 52.
б) Задачи по химическому уравнению с понятиями «избыток» и «недостаток».
• Вычислить массу продукта реакции, если для нее взять 37,2 г анилина и 146 г соляной кислоты 20%.
в) Задачи по химическому уравнению с массовой долей выхода продукта.
• При взаимодействии этанола массой 27,6 г с оксидом меди (II) было получено 25 г уксусного альдегида. Вычислите массовую долю (в %) выхода альдегида к теоретически возможному.
Ответы на вопросы теста
1. а) Солеобразующие оксиды:
Сu2O — оксид меди (I) — основной оксид;
SO2 — оксид серы (IV) — кислотный оксид.
Кислоты:
НСlO4 — хлорная кислота: кислородсодержащая, одноосновная, растворимая, нелетучая, сильная, стабильная;
НВr — бромоводородная кислота: бескислородная, одноосновная, растворимая, сильная, летучая, стабильная.
Основания:
Сr(ОН)3 — гидроксид хрома (III): кислородсодержащий, трехкислотный, нерастворимый, амфотерный, нелетучий, слабый, нестабильный.
Соли:
NaH2PO4 — дигидрофосфат натрия, кислая соль, растворимая;
(СuOН)2СO3 — гидроксокарбонат меди (II), основная соль, нерастворимая;
![]() — комплексное соединение, тетра-гидроксо-алюминат калия, анионный комплекс.
— комплексное соединение, тетра-гидроксо-алюминат калия, анионный комплекс.
б) С4Н10 — предельный углеводород, алкан. СnН2n+2; бутан.
С3Н6 — СnН2n — либо алкен: пропен, непредельный, либо циклоалкан — циклопропан.
Н3С—С≡СН — алкин, непредельный, пропин.
![]() — кислородсодержащий, предельный альдегид, пропаналь.
— кислородсодержащий, предельный альдегид, пропаналь.
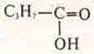 - кислородсодержащая предельная кислота — бутановая кислота.
- кислородсодержащая предельная кислота — бутановая кислота.
![]() — кислородсодержащий, предельный, сложный эфир, этиловый эфир этановой кислоты.
— кислородсодержащий, предельный, сложный эфир, этиловый эфир этановой кислоты.
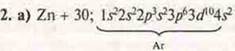 - d-элемент, переходный металл.
- d-элемент, переходный металл.
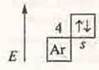
С.О.+ 2.
ZnO — оксид цинка — амфотерный оксид. Zn(OH)2 — амфотерный гидроксид. Гидроксид цинка.
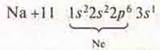 — s-элемент щелочной металл.
— s-элемент щелочной металл.
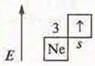
С.О.+ 1
Na2O — оксид натрия, основной оксид. NaOH — гидроксид натрия, основание растворимое, щелочь.
![]() - d-элемент металлический с переходными свойствами.
- d-элемент металлический с переходными свойствами.
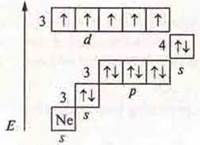
С.О. +2, +4, +7.
С.О. + 7, максимальная. Мn2O7 — оксид марганца (VI), кислотный оксид. НМnO4 — марганцовая кислота, гидроксид.
б)
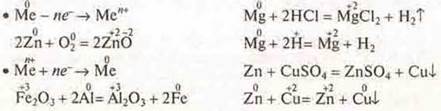
3. Неметаллы.
![]() - p-элемент, неметалл
- p-элемент, неметалл
![]() — бромоводород — водородное соединение.
— бромоводород — водородное соединение.
![]() — оксид брома.
— оксид брома.
HBrO4 — кислота;- бромная кислота; гидроксид-кислота.
N + 7 1s22s22p3 р-элемент, неметалл.
![]() — водородное соединение, аммиак.
— водородное соединение, аммиак.
N2O5 — оксид азота (V).
HNO3 — азотная кислота; гидроксид-кислота.
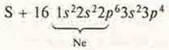 р-элемент, неметалл.
р-элемент, неметалл.
![]() — водородное соединение, сероводород.
— водородное соединение, сероводород.
![]() — оксид серы (VI).
— оксид серы (VI).
H2SO4 — серная кислота; гидроксид-кислота.
б) кислотный характер в ряду слева направо уменьшается:
![]() т. к. С.О. элемента уменьшается, а радиус иона-элемента возрастает.
т. к. С.О. элемента уменьшается, а радиус иона-элемента возрастает.
в) в ряду Н2O — H2S — H2Se — Н2Те слева направо прочность связи уменьшается, так как уменьшается полярность связи (разность в ЭО), возрастает заряд ядра иона-неметалла и его радиус.
4. H2SO4(p ) взаимодействует с:
FeO — основной оксид; Сu(ОН)2 — нерастворимое основание; ВаСl2 — соль, даст осадок.
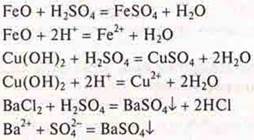
5. HF < HCl < HBr < HI:
HI — самая сильная кислота, к концу этого ряда возрастает радиус иона-неметала и заряд его ядра, что вызывает сильнейшее отталкивание протона — катиона водорода, диссоциация идет легко.
6. a) NH3 > РН3 > AsH3 > SbH3 > BiH3.
С увеличением порядкового номера возрастает заряд ядра иона-неметалла, а также возрастает радиус иона-неметалла, что вызывает ослабление основных свойств — быть донором пары электронов, и нарастают кислотные свойства,
б) NH3 > Н2О > HF.
Основные свойства водородных соединений к концу периода ослабевают, т. к. к концу периода возрастает заряд ядра иона-неметалла, увеличивается его С.О., уменьшается радиус иона-неметалла, усиливаются кислотные свойства — быть донорами протона — катиона водорода.
Раствор нейтральный, pH = 7. Синий лакмус становится фиолетовым.
б) ![]() — оксид хрома (II), основной оксид;
— оксид хрома (II), основной оксид;
Сr(ОН)2 — гидроксид хрома (II), основание нерастворимое;
![]() — оксид хрома (III), амфотерный оксид;
— оксид хрома (III), амфотерный оксид;
Сr(ОН)3 — гидроксид хрома (III), амфотерное основание;
![]() — оксид хрома (VI), кислотный оксид;
— оксид хрома (VI), кислотный оксид;
Н2СrO4 — хромовая кислота.
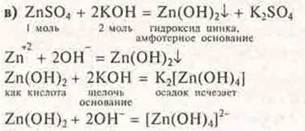
В избытке щелочи гидроксид цинка проявляет кислотные в этом случае свойства.
Осадок исчезает, т.к. образуется растворимое комплексное соединение цинка тетра-гидроксоцинкат калия.
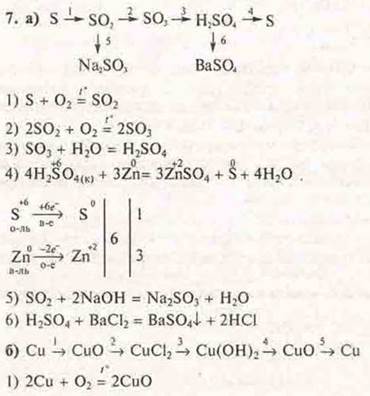
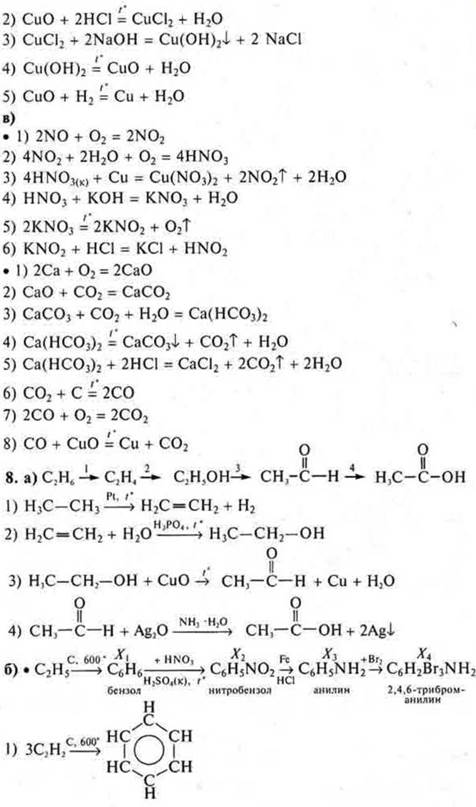

б) Восстановитель — частица (молекула, ион, атом), повышающая в ОВР С.О. (отдает электроны — окисляется). Окислитель — частица (молекула, ион, атом), понижающая в ОВР С.О. (принимает электроны — восстанавливается).
в) ![]() — в максимальной С.О. это окислитель;
— в максимальной С.О. это окислитель;
![]() — в промежуточной С.О. в зависимости от условий может быть и окислителем, и восстановителем;
— в промежуточной С.О. в зависимости от условий может быть и окислителем, и восстановителем;
![]() — в минимальной С.О. только восстановитель.
— в минимальной С.О. только восстановитель.
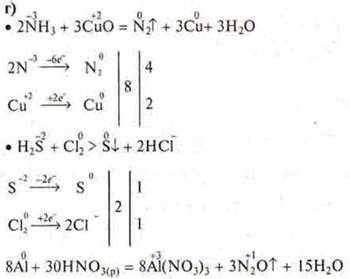

3) mO = 2,52 - 2,16 - 0,36 = 0 — нет кислорода в соединении.
4) х : у = 0,18 : 0,36 = 1 : 2.
СН2 — простейшая формула, mСН2 = 14 г/моль.

3) ![]() у = 0,8 моль анилина требуется, а дано 0,4 ⇒ анилин в недостатке. Расчет ведем по недостатку.
у = 0,8 моль анилина требуется, а дано 0,4 ⇒ анилин в недостатке. Расчет ведем по недостатку.
4) ![]()
Ответ: масса продукта реакции 51,8 г.
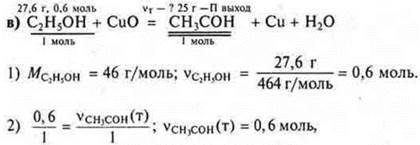
m теоретического выхода ![]()