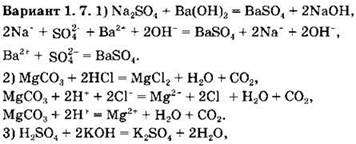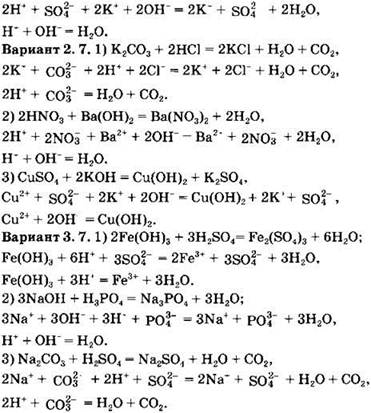Химия 8 класс контрольные измерительные материалы - 2016 год
Ответы
Раздел 1.
Чистые вещества и смеси. Разделение смесей и очистка веществ. Лабораторная посуда и оборудование. Правила безопасной работы в школьной лаборатории
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
3 |
|
2 |
2 |
2 |
4 |
|
3 |
1 |
3 |
1 |
|
4 |
2 |
4 |
3 |
|
5 |
1 |
5 |
3 |
Химический элемент. Относительная атомная масса. Простые и сложные вещества
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
4 |
1 |
3 |
|
2 |
4 |
2 |
2 |
|
3 |
3 |
3 |
3 |
|
4 |
1 |
4 |
2 |
|
5 |
4 |
5 |
2 |
|
6 |
2 |
6 |
3 |
Вариант 3. 1. Группа первая: 1, 3, 5. Группа вторая: 2, 4, 6. Признак деления суждений на группы: о чём идёт речь в суждении — простом веществе или химическом элементе?
3. 1) Са — формула простого вещества (остальные вещества — сложные); 2) N2O5— формула сложного вещества (остальные вещества — простые).
Химическая формула. Относительная молекулярная масса. Вычисления массовой доли химического элемента в веществе
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
4 |
|
2 |
2 |
2 |
3 |
|
3 |
1 |
3 |
2 |
Вариант 1. 4. 1) Р4; 2) N2O3; 3) NH3; 4) Н3РO4. 5. 1) 28; 2) 17; 3) 98; 4) 74.
Вариант 2. 4. 1) N2; 2) Р2O5; 3) H2S; 4) H2SiO3. 5. 1) 48; 2) 34; 3) 78; 4) 180.
Вариант 3. 2. 1) S8; 2) SO3; 3) СН2Сl2; 4) Н2СO3. 4. 1) 38; 2) 34; 3) 32; 4) 63.
Валентность
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
1 |
1 |
2 |
|
2 |
4 |
2 |
2 |
|
3 |
3 |
3 |
4 |
|
4 |
2 |
4 |
2 |
Вариант 1. 5. 1) K2S; 2) MgS; 3) Fe2S3.
Вариант 2. 5. 1) Li3N; 2) Ca3N2; 3) AlN.
Вариант 3. 2. Группа первая: калий, магний, водород, кислород. Группа вторая: железо, сера, фосфор, хром. Признак, по которому элементы разделили на группы, — валентность, проявляемая элементами в соединениях (группа первая — элементы с постоянной степенью окисления; группа вторая — элементы с переменной степенью окисления).
3. 1) SCl6 — формула вещества, в котором валентность серы равна VI (в остальных веществах валентность серы равна IV);
2) Fe2O3— формула вещества, в котором валентность железа равна III (в остальных веществах валентность железа равна II).
4. 1) К4С; 2) Mg4C2; 3) Аl4С3.
Физические и химические явления. Условия и признаки протекания химических реакций. Сохранение массы веществ при химических реакциях
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
3 |
1 |
2 |
|
2 |
2 |
2 |
3 |
|
3 |
4 |
3 |
2 |
Вариант 3. 1. Группа первая: 1, 3, 5, 8. Группа вторая: 2, 4, 6, 7. Признак, по которому элементы разделили на группы, — тип явления (группа первая — физические явления; группа вторая — химические явления).
Вычисления, связанные с использованием понятия “массовая доля растворённого вещества в растворе”
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
4 |
1 |
3 |
|
2 |
2 |
2 |
1 |
|
3 |
2 |
3 |
3 |
Вариант 4. 1. 10,71%. Способы решения: расчёт с использованием формул, расчёт “методом стаканчиков”, расчёт “методом креста”.
2. 25 г.
Раздел 2.
Оксиды: состав и названия
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
2 |
|
2 |
3 |
2 |
245 |
|
3 |
3 |
3 |
246 |
Вариант 3. 3. Группа первая: Na2O, ВаО, Аl2O3. Группа вторая: N2O3, N2O, CUO. Признак, по которому оксиды разделили на группы, — тип химического элемента, образующего оксид (группа первая — оксиды, образованные элементами с постоянной валентностью; группа вторая — оксиды, образованные элементами с переменной валентностью).
Оксиды: классификация и химические свойства
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
3 |
1 |
2 |
|
2 |
3 |
2 |
3 |
|
3 |
1 |
3 |
1 5 6 |
|
4 |
2 |
4 |
2 4 6 |
|
5 |
1 3 5 |
5 |
2 4 5 |
|
6 |
1 3 5 |
6 |
1 2 3 |
|
7 |
1 3 |
7 |
3 4 |
Вариант 1. 8. ![]()
![]()
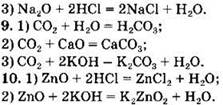
Вариант 2. 8. ![]()
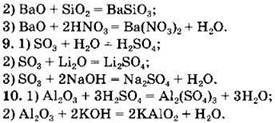
Вариант 3. 1. 1) CO — несолеобразующий оксид (остальные — солеобразующие); 2) СO2 — кислотный оксид (остальные — основные); 3) MgO — основный оксид (остальные — кислотные); 4) СrО — основный оксид (остальные — амфотерные).
Кислоты: состав, классификация, названия и составление формул
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
146 |
1 |
2 3 5 |
|
2 |
1 |
2 |
3 |
|
3 |
1 |
3 |
4 |
|
4 |
1 4 |
4 |
3 5 |
|
5 |
2 3 5 |
5 |
2 6 |
Вариант 3. 2. 1) фосфорная кислота — трёхосновная кислота (остальные кислоты — одноосновные); 2) кремниевая кислота — нерастворимая кислота (остальные кислоты — растворимые).
4. 2, 6.
5. 1-й способ решения. Группа первая: серная кислота H2SO4, сернистая кислота H2SO3 — двухосновные, кислородсодержащие кислоты, образованные серой. Группа вторая: азотная кислота HNO3, азотистая кислота HNO2 — одноосновные, кислородсодержащие кислоты, образованные азотом. Признак, по которому кислоты делили на группы: состав кислот — количество водорода в молекулах кислот и элемент, образующий кислоту. Признак, по которому кислоты делили на группы: состав кислот.
2-й способ решения. Группа первая: серная кислота H2SO4, азотная кислота HNO3 — кислородсодержащие кислоты, образованные элементами, проявляющими высшую валентность. Группа вторая: сернистая кислота H2SO3, азотистая кислота HN02— кислородсодержащие кислоты, образованные элементами, проявляющими промежуточную валентность. Признак, по которому кислоты делили на группы: состав кислот — валентность элемента, образующего кислоту.
Кислоты: химические свойства
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
2 |
|
2 |
4 |
2 |
4 |
|
3 |
3 |
3 |
2 |
|
4 |
2 3 5 |
4 |
2 4 6 |
|
5 |
2 |
5 |
3 |
|
6 |
4 |
6 |
3 |
Вариант 1. 7. ![]()
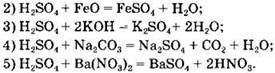
Вариант 2. 7. ![]()

Вариант 3. 3. 1) магний — металл, взаимодействующий с кислотами (остальные металлы с кислотами не взаимодействуют); 2) золото — металл, не взаимодействующий с кислотами (остальные металлы с кислотами взаимодействуют).
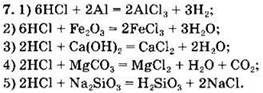
Соли: состав, классификация, названия и составление формул
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
1 |
1 |
2 |
|
2 |
2 |
2 |
4 |
|
3 |
1 |
3 |
2 |
|
4 |
2 |
4 |
3 |
|
5 |
1 |
5 |
3 |
Вариант 4. 2. Схема классификации солей по составу.
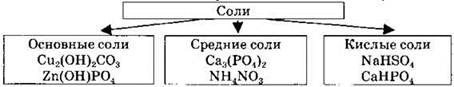
4. Группа первая: 1, 5 — сульфаты. Группа вторая: 2, 6 — сульфиты. Группа третья: 3, 4 — сульфиды. Признак, по которому соли делили на группы, — состав солей — кислотный остаток, образующий соль.
Соли: химические свойства
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
4 |
|
2 |
1 |
2 |
2 |
|
3 |
4 |
3 |
2 |
|
4 |
4 |
4 |
3 |
|
5 |
3 |
5 |
2 |
Вариант 1. 6. ![]()
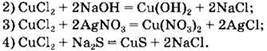
Вариант 2. 6. ![]()
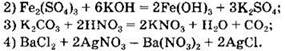
Вариант 3. 6. ![]()
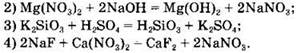
Основания: состав, классификация и составление формул и названий
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
3 |
1 |
2 |
|
2 |
3 |
2 |
2 |
|
3 |
1 5 6 |
3 |
1 4 5 |
|
4 |
3 4 5 |
4 |
2 3 4 |
Вариант 3. 1. ![]()
![]()
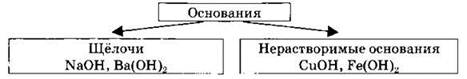
2. Классификация оснований по растворимости.
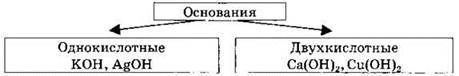
Классификация веществ по числу гидроксогрупп.
4. Группа 1: гидроксид калия КОН, гидроксид лития LiOH. Группа 2. Гидроксид бария Ва(ОН)2, гидроксид свинца (II) Рb(ОН)2. Признак, по которому основания делили на группы, — состав оснований — количество ОН-групп.
Основания: химические свойства
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
4 |
1 |
2 |
|
2 |
4 |
2 |
1 |
|
3 |
1 3 6 |
3 |
1 2 3 |
|
4 |
2 |
4 |
1 |
|
5 |
3 4 5 |
5 |
3 5 6 |
|
6 |
1 |
6 |
4 |
Вариант 1. 7. ![]()
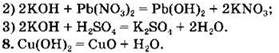
Вариант 2. 7. ![]()
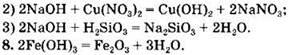
Генетическая связь между классами неорганических соединений
|
Вариант 1 |
Вариант 2 |
Вариант 3 |
|||
|
Задание |
Ответ |
Задание |
Ответ |
Задание |
Ответ |
|
1 |
1 |
1 |
3 |
1 |
2 |
|
2 |
2 |
2 |
4 |
2 |
1 |
|
3 |
2 |
3 |
1 |
||
Вариант 1. 4. Группа 1: Li, LiNO3, Li2O, LiOH. Группа 2: P2O5, H3PO4, P, Mg3(PO4)2. Признак, по которому вещества делили на группы, — вещества, образующие один генетический ряд.
Генетический ряд лития: ![]()
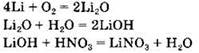
Генетический ряд фосфора: ![]()
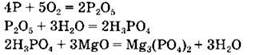
Вариант 2. 4. Группа 1: СаСl2, CaO, Ca(OH)2, Ca. Группа 2: C, H2CO3, Na2CO3, CO2. Признак, по которому вещества делили на группы, — вещества, образующие один генетический ряд.
Генетический ряд кальция: ![]()
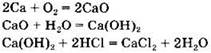
Генетический ряд углерода: ![]()
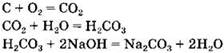
Вариант 3. 1) оксид углерода (II) → угольная кислота — превращение нельзя осуществить в одну стадию (остальные превращения можно осуществить в одну стадию);
2) гидроксид железа (III) → оксид железа (II) — превращение нельзя осуществить в одну стадию (остальные превращения можно осуществить в одну стадию).
4. Группа 1: Ва, Ва(ОН)2, BaO, Ba(NO3)2. Группа 2: Na2SeO3, Se, SeO2, H2SeO3. Генетический ряд бария: Ва → ВаО → Ва(ОН)2→ Ba(NO3)2.
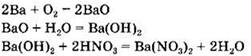
Генетический ряд селена: ![]()
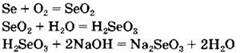
Раздел 3.
Строение атома (на примере первых 20 элементов Периодической системы Д.И. Менделеева)
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
1 |
1 |
3 |
|
2 |
3 |
2 |
3 |
|
3 |
4 |
3 |
1 |
|
4 |
2 |
4 |
3 |
|
5 |
2 |
5 |
4 |
|
6 |
1 |
6 |
3 |
|
7 |
3 |
7 |
2 |
|
8 |
4 |
8 |
1 |
Периодический закон и Периодическая система химических элементов Д.И. Менделеева
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
1 |
|
2 |
1 |
2 |
3 |
|
3 |
2 |
3 |
4 |
|
4 |
2 |
4 |
3 |
|
5 |
3 |
5 |
4 |
|
6 |
3 |
6 |
1 |
|
7 |
4 |
7 |
2 |
|
8 |
1 |
8 |
2 |
|
9 |
3 |
9 |
3 |
|
10 |
2 |
10 |
4 |
Вариант 3. 5. 1) селен → сера → кислород — заряд ядра атома уменьшается (в остальных последовательностях заряд ядра атома увеличивается);
2) кремний → фосфор → сера — заряд ядра атома уменьшается (в остальных последовательностях заряд ядра атома увеличивается).
6. 1) натрий → магний → алюминий — число электронных слоёв в атоме увеличивается (в остальных последовательностях число электронных слоёв в атоме уменьшается);
2) калий → натрий → литий — число электронных слоёв в атоме уменьшается (в остальных последовательностях число электронных слоёв в атоме увеличивается).
7. 1) натрий → магний → алюминий — число электронов во внешнем электронном слое увеличивается (в остальных последовательностях число электронов во внешнем электронном слое уменьшается);
2) кислород → азот → углерод — число электронов во внешнем электронном слое уменьшается (в остальных последовательностях число электронов во внешнем электронном слое увеличивается).
8. 1) бром → хлор → фтор — радиус атома уменьшается (в остальных последовательностях радиус атома увеличивается);
2) калий → натрий → литий — радиус атома уменьшается (в остальных последовательностях радиус атома увеличивается).
9. 2) бериллий → магний → кальций — металлические свойства усиливаются (в остальных последовательностях металлические свойства ослабевают).
10. 2) мышьяк → фосфор → азот — кислотные свойства усиливаются (в остальных последовательностях кислотные свойства ослабевают).
Химическая связь
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
3 |
1 |
4 |
|
2 |
4 |
2 |
2 |
|
3 |
1 4 6 |
3 |
2 5 6 |
|
4 |
2 4 6 |
4 |
2 5 6 |
|
5 |
2 |
5 |
3 |
|
6 |
4 |
6 |
4 |
Вариант 3. 2. Оксид углерода (IV) — в молекуле четыре общие электронные пары (в молекулах остальных веществ по три общие электронные пары).
Степень окисления
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
3 |
1 |
2 |
|
2 |
1 |
2 |
1 |
|
3 |
3 |
3 |
1 |
Раздел 4.
Химические уравнения
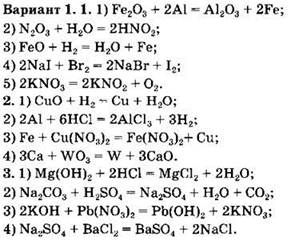
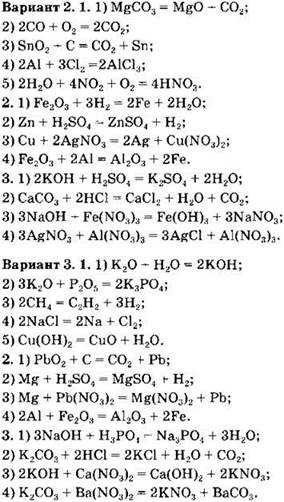
Классификация химических реакций по различным признакам
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 4 6 |
1 |
1 4 6 |
|
2 |
3 |
2 |
2 |
|
3 |
2 |
3 |
4 |
|
4 |
2 |
4 |
2 |
Вариант 3. 1. Классификация реакций по признаку “число и состав исходных веществ и продуктов реакции”.
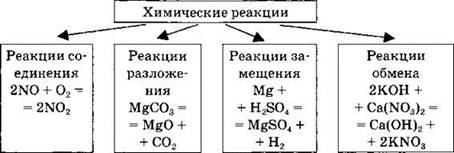
Классификация химических реакций по изменению степеней окисления химических элементов. Окислитель и восстановитель
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
2 |
1 |
4 |
|
2 |
3 |
2 |
4 |
|
3 |
3 1 2 |
3 |
4 1 5 |
|
4 |
6 4 1 |
4 |
5 1 3 |
|
5 |
2 4 5 |
5 |
5 3 5 |
Вариант 1. 6. ![]()
![]()
МnO2 — окислитель, НСl — восстановитель.
Вариант 2. 6. ![]()
![]()
HNO3 — окислитель, Сu — восстановитель.
|
Вариант 3 |
|
|
Задание |
Ответ |
|
3 |
1 4 3 |
|
4 |
5 4 2 |
|
5 |
1 5 2 |

КСlO3 — окислитель, S — восстановитель.
Электролиты и неэлектролиты. Электролитическая диссоциация
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
3 |
1 |
4 |
|
2 |
2 |
2 |
1 |
|
3 |
4 |
3 |
2 |
|
4 |
2 |
4 |
3 |
|
5 |
4 |
5 |
3 |
|
6 |
1 |
6 |
4 |
|
7 |
4 |
7 |
2 |
|
8 |
3 |
8 |
3 |
|
9 |
3 |
9 |
2 |
Реакции ионного обмена
|
Вариант 1 |
Вариант 2 |
||
|
Задание |
Ответ |
Задание |
Ответ |
|
1 |
4 |
1 |
2 |
|
2 |
1 |
2 |
2 |
|
3 |
2 |
3 |
3 |
|
4 |
1 |
4 |
3 |
|
5 |
2 |
5 |
2 |
|
6 |
4 |
6 |
3 |