Диагностические работы химия 9 класс - 2017 год
ВАРИАНТ 10
Часть 1
Для выполнения заданий 1-15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа.
1. Схема распределения электронов по энергетическим уровням +Z )2)8 соответствует частицам:
1) Li+ и Ne
2) Аl3+ и S2-
3) Mg2+ и О2-
4) Аr и Сl-
![]()
2. В ряду химических элементов С → В → Be → Li увеличивается:
1) основный характер оксидов, образованных данными элементами
2) степень окисления в высших оксидах
3) число электронов на внешнем энергетическом уровне
4) окислительные свойства простых веществ, образованных этими элементами
![]()
3. И ковалентная полярная и ионная связь присутствует в веществе:
1) H2SO4
2) Р4О10
3) NaNO3
4) ZnCl2
![]()
4. Низшую степень окисления азот проявляет в веществе:
1) Mg3N2
2) N2H4
3) Ca(NO3)2
4) NF3
![]()
5. Вещества, формулы которых — N2O3и Fe(OH)3, являются соответственно:
1) амфотерным оксидом и амфотерным гидроксидом
2) кислотным оксидом и основанием
3) кислотным оксидом и амфотерным гидроксидом
4) несолеобразующим оксидом и основанием
![]()
6. Реакция между иодидом калия и хлором относится к реакциям:
1) соединения
2) замещения
3) разложения
4) обмена
![]()
7. Электрический ток проводит:
1) раствор сахара
2) 100%-ная серная кислота
3) 10%-ный раствор серной кислоты
4) раствор спирта
![]()
8. Сокращенное ионное уравнение, соответствующее молекулярной реакции Fe(OH)3+ 3HNO3 = Fe(NO3)3+ 3H2O:
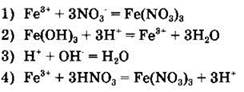
![]()
9. С водой при комнатной температуре реагируют оба вещества из набора:
1) оксид бария и калий
2) оксид меди и кальций
3) оксид серы (IV) и сера
4) оксид цинка и медь
![]()
10. Железо реагирует с каждым из двух веществ:
1) NaOH и НСl
2) H2O и ZnCl2
3) S и CuSO4
4) Na2O и H2SO4
![]()
11. В реакцию и с раствором гидроксида лития и с хлоридом бария вступает:
1) бромид магния
2) оксид азота (V)
3) фосфат кальция
4) сульфат меди (II)
![]()
12. В реакцию с хлоридом железа (III) вступают все вещества набора:
1) Mg, NaOH, HNO3
2) Fe, AgNO3, NaOH
3) Br2, NaOH, AgNO3
4) Zn, Cu(OH)2, K2S
![]()
13. Верными ли являются утверждения? А) Все галогены ядовиты; Б) Оксид углерода (II) можно собирать, вытесняя воду из сосуда:
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
![]()
14. Водород проявляет окислительные свойства в реакциях с:
1) калием
2) серой
3) оксидом меди (II)
4) углеродом
![]()
15. Массовые доли элементов в гидроксиде алюминия равны:
1) Аl — 34,6%, О — 61,5%
2) Аl — 61,4%, О — 36,4%
3) Аl — 44,3%, Н — 3,3%
4) О —36,4%, Н —2,3%
![]()
При выполнении заданий № 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
16. В ряду оксидов Р2O5 → SО3→ Сl2O7:
1) увеличиваются кислотные свойства оксидов
2) уменьшается степень окисления элементов, образующих оксиды
3) возрастают молярные массы оксидов
4) увеличивается сила кислот, соответствующих данным оксидам
5) уменьшается число атомов в молекулах оксидов
Ответ: ![]()
17. Для метана и этилена верны следующие утверждения:
1) вещества относятся к классу алканов
2) относятся к углеводородам
3) содержат одинаковое число атомов углерода
4) вещества не горят на воздухе
5) являются газами
Ответ: ![]()
При выполнении заданий № 18 и 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите в таблицы выбранные цифры под соответствующими буквами. Цифры в ответах могут повторяться.
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
|
ВЕЩЕСТВА |
РЕАКТИВ |
|
A) NaCl и Na2SO3 |
1) НСl |
|
Б) АlСl3 и MgCl2 |
2) КОН |
|
В) НСl и HNO3 |
3) K2SO4 |
|
4) AgNO3 |
Ответ: 
19. Установите соответствие между названием вещества и peaгентами, с которыми это вещество может взаимодействовать.
|
НАЗВАНИЕ ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
A) NH3 |
1) I2, Са(ОН)2 |
|
Б) НВr |
2) НСl, АlСl3 |
|
В) ZnCl2 |
3) НСl, КOН |
|
4) AgNO3, Mg |
Ответ: 
Часть 2
Для заданий 20-22 дайте развернутый ответ.
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой H2S + O2 → SO2 + Н2O. Определите окислитель и восстановитель.
21. Какая масса железа может быть получена из 3 кг бурого железняка, содержащего 92,8% оксида железа (II, III) (Fe3O4), методом алюмотермии?
22. Даны вещества Сu, O2, раствор H2SO4, AgNO3, КОН. Используя воду и необходимые вещества только из этого списка, получите в две стадии сульфат меди (II). Для реакции ионного обмена напишите сокращенное ионное уравнение.