Диагностические работы химия 9 класс - 2017 год
ВАРИАНТ 8
Часть 1
Для выполнения заданий 1-15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа.
1. Схема распределения электронов по энергетическим уровням атома кремния:
1) )2)4
2) )2)8)2
3) )2)8)4
4) )2)4)8
![]()
2. В ряду химических элементов Р → S → F увеличиваются(-ется):
1) металлические свойства
2) валентность в летучем водородном соединении
3) основный характер оксида
4) число электронов на внешнем энергетическом уровне
![]()
3. Одинаковый тип химических связей реализуется в оксиде натрия и:
1) оксиде серы (IV)
2) хлориде калия
3) хлороводороде
4) серной кислоте
![]()
4. Фосфор имеет одинаковые степени окисления в веществах:
1) Р2O5 И H3PO3
2) РН3 и РСl3
3) РН3 и Na3P
4) NaH2PO2 и Na3PO4
![]()
5. Только кислотные оксиды содержатся в ряду:
1) СO2, Сl2O7, SO3
2) N2O5, Na2O, SiO2
3) CO, P2O5, SO2
4) Al2O3, N2O3, Cl2O5
![]()
6. Ярко-желтый осадок выпадает в результате реакции взаимодействия растворов веществ:
1) AgNO3 и NaCl
2) AgNO3 и Na3PO4
3) Pb(NO3)2 и Na2S
4) Ba(NO3)2 и Na2SO4
![]()
7. Частицы, содержащиеся в растворе сероводородной кислоты, — это:
1) H2S, HS-, S2-, Н+
2) H2S, S2-, Н+
3) S2-, Н+
4) HS-, S2-, Н+
![]()
8. Осадок и газ одновременно образуются при взаимодействии:
1) MgCO3 + НСl
2) Na2SO4 + ВаСl2
3) Na2S + НСl
4) H2SO4 + ВаСO3
![]()
9. Ионы, которые могут одновременно находиться в растворе, — это:
1) Na+, Fe2+, ОН
2) Cl-, Mg2+, Ba2+
3) Са2+, F-, Ag+
4) S2-, K+, Cu2+
![]()
10. Оксид кремния (IV) реагирует с каждым из двух веществ:
1) КOН и Н2O
2) ВаО и HNO3
3) СаО и СаСO3
4) HNO3 и KOH
![]()
11. В реакцию с раствором гидроксида бария вступает:
1) гидроксид натрия
2) нитрат калия
3) хлорид меди (II)
4) оксид углерода (II)
![]()
12. Хлорид железа (II) вступает в реакцию со всеми веществами ряда:
1) Fe, NaCl, Cu(NO3)2
2) Сu, AgNO3, NaOH
3) Zn, AgNO3, КОН
4) Pb(NO3)2, КОН, Zn(OH)2
![]()
13. Верны ли суждения о правилах работы в лаборатории? А) Работу с крепкими щелочами следует проводить в перчатках; Б) Любые газы можно собирать методом вытеснения воды:
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
![]()
14. Фосфор является окислителем в реакции:
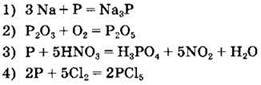
![]()
15. Массовые доли элементов в карбонате лития равны:
1) Li — 10,45%, О — 71,64%
2) Li — 18,9%, О — 64,9%
3) Li — 13,73%, С — 23,53%
4) Li — 70%, С — 30%
![]()
При выполнении заданий № 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
16. Фосфор и азот отличаются:
1) агрегатным состоянием образованных ими простых веществ
2) числом электронов на внешнем энергетическом уровне
3) характером высших оксидов
4) электроотрицательностью
5) числом неспаренных электронов на внешнем энергетическом уровне атомов в основном состоянии
Ответ: ![]()
17. Для уксусной кислоты верны следующие утверждения:
1) действует на индикатор
2) в молекуле все связи одинарные
3) содержит карбоксильную группу
4) не имеет запаха
5) содержит один атом углерода в молекуле
Ответ: ![]()
При выполнении заданий № 18 и 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите в таблицы выбранные цифры под соответствующими буквами. Цифры в ответах могут повторяться.
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
|
ВЕЩЕСТВА |
РЕАКТИВ |
|
A) NaNO3и Na2CO3 |
1) Сu |
|
Б) Аl(OН)3 и Mg(OH)2 |
2) НСl |
|
В) Разбавленные H2SO4 и HNO3 |
3) Zn(OH)2 |
|
4) КОН |
Ответ: 
19. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
|
НАЗВАНИЕ ВЕЩЕСТВА |
РЕАГЕНТЫ |
|
А) хлорид железа (III) |
1) Н2O, NaOH |
|
Б) сероводород |
2) NaNO3, Zn |
|
В) оксид азота (V) |
3) Pb(NO3)2, O2 |
|
4) КОН, Mg |
Ответ: 
Часть 2
Для заданий 20-22 дайте развернутый ответ.
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой NH3 + CuO → Сu + N2 + Н2О. Определите окислитель и восстановитель.
21. К 450 г раствора серной кислоты добавили избыток магния. В результате реакции выделилось 11,2 л (н.у.) газа. Определите массовую долю серной кислоты в исходном растворе.
22. Даны вещества N2О5, NaNО3, разбавленная H2SО4, Ва(ОН)2, NO. Используя воду и необходимые вещества только из этого списка, получите в две стадии азотную кислоту. Для реакции ионного обмена напишите сокращенное ионное уравнение.