Химия 9 класс - поурочные разработки
Оксид серы (VI). Серная кислота и её соли
Цели урока: познакомить учащихся со свойствами серной кислоты и оксида серы; рассмотреть химические и физические свойства серной кислоты.
Ход урока
1. Организационный момент
2. Изучение нового материала
Оксид серы (VI) - SO3 (серный ангидрид)
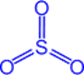
Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах).
SO3 + H2O → H2SO4
SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Получение
1) 2SO2 + O2 → 2SO3 (катализатор – V2O5, при 450˚С)
2) Fe2(SO4)3 → Fe2O3 + 3SO3 (разложение при нагревании)
Химические свойства:
1) Серный ангидрид - кислотный оксид.
Взаимодействие с водой
При растворении в воде дает сильную двухосновную серную кислоту:
SO3 + H2O → H2SO4
Диссоциация протекает ступенчато:
H2SO4 → H+ + HSO4- (первая ступень, образуется гидросульфат – ион)
HSO4- → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
Взаимодействие со щелочами
2NaOH + SO3 → Na2SO4 + H2O
NaOH + SO3 (избыток) → NaHSO4
Взаимодействие с основными оксидами
Na2O + SO3 → Na2SO4
2) SO3 - сильный окислитель.
СЕРНАЯ КИСЛОТА - H2SO4
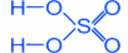
Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r = 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните! Кислоту вливать малыми порциями в воду, а не наоборот!

Производство серной кислоты.
1-я стадия. Печь для обжига колчедана
4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
Процесс гетерогенный:
1) измельчение железного колчедана (пирита);
2) метод "кипящего слоя";
3) 800°С; отвод лишнего тепла;
4) увеличение концентрации кислорода в воздухе;
2-я стадия. Контактный аппарат
После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450 °С – 500 °С; катализатор V2O5):
2SO2 + O2 → 2SO3
3-я стадия. Поглотительная башня
nSO3 + H2SO4 (конц) → (H2SO4 · nSO3) (олеум)
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Химические свойства разбавленной серной кислоты.
H2SO4 - сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
1) Диссоциация протекает ступенчато:
H2SO4→ H+ + HSO4- (первая ступень, образуется гидросульфат – ион)
HSO4- → H+ + SO42- (вторая ступень, образуется сульфат – ион)
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2+1SO4 (разб.) → Zn+2SO4 + H20↑
Zn0 + 2H+ → Zn2+ + H20↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+ + H2O
4) Взаимодействие с основаниями:
H2SO4 + 2NaOH → Na2SO4 + 2H2O (реакция нейтрализации)
H+ + OH- → H2O
Если кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2H+ + Cu(OH)2 → Cu2+ + 2H2O
5) Обменные реакции с солями:
образование осадка
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
Видео "Качественная реакция на сульфит- и сульфат-ионы":
образование газа - как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
MgCO3 + H2SO4 → MgSO4 + H2O + CO2↑
MgCO3 + 2H+ → Mg2+ + H2O + CO2↑
Серную кислоту применяют:
· в производстве минеральных удобрений;
· как электролит в свинцовых аккумуляторах;
· для получения различных минеральных кислот и солей;
· в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
· в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
· в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
· в промышленном органическом синтезе в реакциях:
· дегидратации (получение диэтилового эфира, сложных эфиров);
· гидратации (получение этанола);
· сульфирования (получение СМС и промежуточные продукты в производстве красителей);
· и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Применение солей серной кислоты.
Железный купорос FеSО4 · 7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4 · 5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4 · 10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.
«Бариевая каша» BaSO4 обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Гипс СаSO4 · 2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.

3. Закрепление изученного материала
№ 1. Осуществите превращения по схеме:
1) Zn → ZnSO4 →Zn(OH)2 → ZnSO4 -> BaSO4
2) S → SO2 → SO3 → H2SO4 → K2SO4
№ 2. Закончите уравнения практически осуществимых реакций в полном и кратком ионном виде:
Na2CO3 + H2SO4 →
Cu + H2SO4 (раствор) →
Al(OH)3 + H2SO4 →
MgCl2 + H2SO4 →
4. Домашнее задание
П. 13.
Задание.
Запишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком ионном виде.