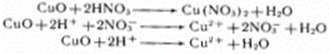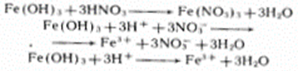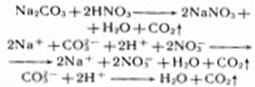Химия 9 класс - поурочные разработки
Окислительные свойства азотной кислоты
Цели урока: знать строение, свойства и применение азотной кислоты, особые свойства азотной кислоты (взаимодействие с металлами); уметь доказывать химические свойства азотной кислоты, записывать уравнения реакций в свете представлений об электролитической диссоциации и окислительно-восстановительных процессах.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.

Химические свойства азотной кислоты
Для азотной кислоты характерны свойства: общие с другими кислотами и специфические:
Химические свойства азотной кислоты |
|
общие с другими солями |
специфические |
1. Вследствие почти полной диссоциации
Азотная кислота (аналогично соляной и серной) является сильной кислотой 2. Реагируют с основными оксидами:
3. Реагируют с основаниями:
4. Реагирует с солями более слабых и более летучих кислот (см. ряд вытесняемости кислот):
|
1. При нагревании и под действием света концентрированная азотная кислота разлагается::
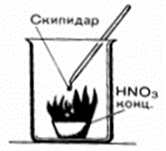
Вследствие этого азотная кислота является сильным окислителем: а) тлеющая лучинка в нагретой концентрированной азотной кислоте загорается (рис. 1); б) скипидар (рис. 2) и древесные опилки в концентрированной азотной кислоте воспламеняются:
Рис. 1
Рис. 2 |
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ:
1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Изменение цветов индикаторов в кислотах
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
3. Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
H+ + OH- → H2O
4. Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ:
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→N-3 окислитель, восстанавливается.
1. Разлагается на свету и при нагревании
4HNO3 t˚C→ 2H2O + 4NO2 + O2
Образуется бурый газ

2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция").
3. Реагирует с металлами.
В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться разные азотсодержащие продукты.
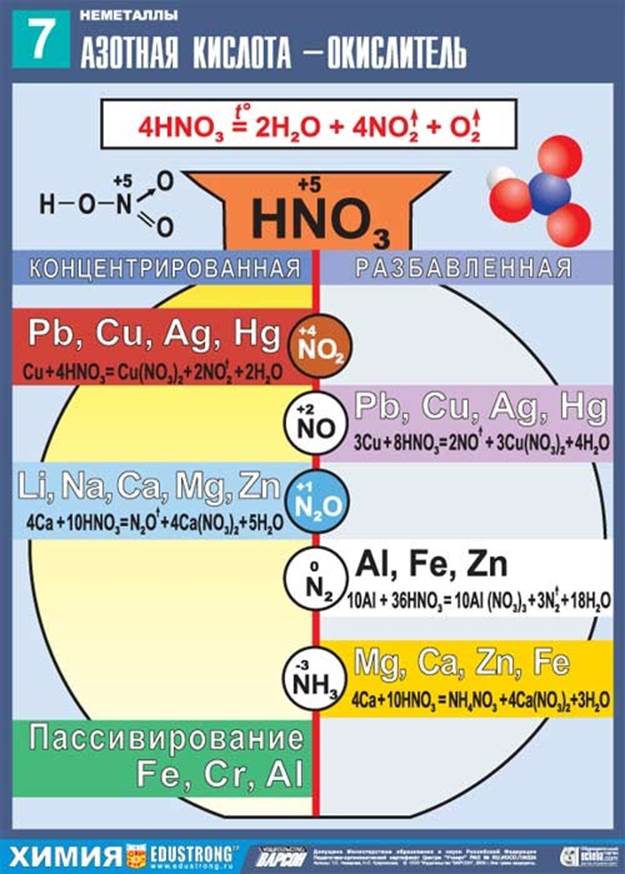
При взаимодействии с металлами никогда не выделяется водород
HNO3 + Me = соль + H2O + Х
Таблица. Продукты реакции взаимодействия азотной кислоты с металлами
Щелочные и щелочноземельные |
Fe, Cr, Al, Ni, Co |
Металлы до водорода |
Металлы после водорода (Cu и др.) |
Благородные Au, Pt, Os, Ir,Ta |
|
HNO3 (конц.ω>60%) |
N2O |
пассивация (при обычных условиях); NO2 (при нагревании) |
NO2 |
NO2 |
Нет реакции |
HNO3 (разбавл.) |
NH3, NH4NO3 |
Основной NO, но в зависимости от разбавления могут образовываться N2,N2O, NH3, NH4NO3. Чем больше разбавлена кислота, тем ниже степень окисления азота. |
NO |
||
Взаимодействие меди с азотной кислотой
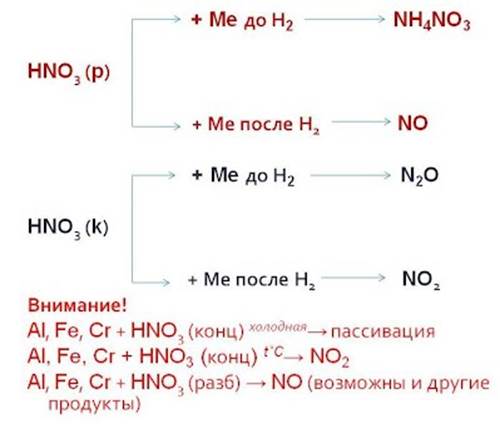
Упрощенная схема «Продукты реакции взаимодействия азотной кислоты с металлами»
Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
4. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
3. Закрепление изученного материала
№ 1. Осуществите превращения по схеме, назовите вещества, для УХР со * составить ОВ баланс, а для** разбор РИО:
NH4Cl**→ NH3* → N2 → NO → NO2 → HNO3 → NO2
№ 2. Осуществить превращения по схеме (внимательно посмотрите, куда направлены стрелки):
Соль аммония←Аммиак←Нитрид Лития ←Азот → Оксид азота (II)←Азотная кислота
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№ 3. Напишите уравнения реакций взаимодействия азотной кислоты со следующими веществами в молекулярном и ионном виде:
a) Al2O3
б) Ba(OH)2
в) Na2S
№ 4. Запишите уравнения, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
А) Сa + HNO3 (конц.)
Б) Сa + HNO3 (paзбавл.)
4. Домашнее задание
П. 19, упр. 1, 6 (а), задача 3 на стр. 60.