Химия 9 класс - поурочные разработки
Непредельные углеводороды. Этилен. Физические и химические свойства. Применение
Цели урока: дать первоначальное понятие об органической химии, органических веществах, их составе, строении, свойствах в сравнении с неорганическими веществами; дать краткую историческую справку о развитии органической химии; рассмотреть непредельные углеводороды, их физические и химические свойства.
Ход работы
1. Организационный момент урока.
Ответить на вопросы:
1. Алкан, имеющий молекулярную формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3. Французский химик, имя которого носит реакция получения углеводородов с более длинной углеродной цепью взаимодействием галогенопроизводных предельных углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы метана.
5. Трихлорметан.
6. Название радикала С2Н5–.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных условиях.
2. Изучение нового материала
АЛКЕНЫ
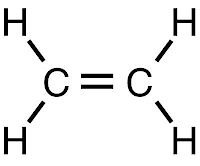
Углеводородами ряда этилена, или этиленовыми углеводородами (олефинами или алкенами) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной двойной связи между углеродными атомами, т. е. – группировки >C=C<.
Этиленовые углеводороды образуют гомологический ряд, состав каждого члена которого выражается общей эмпирической формулой CnH2n. Родоначальником этого ряда является углеводород этилен состава С2Н4, строение которого может быть представлено следующей структурной и упрощенной структурной формулами:
Гомологический ряд алкенов
СnH2n алкен |
Названия, суффикс ЕН |
C2Н4 |
этен, этилен |
C3H6 |
пропен |
C4H8 |
бутен |
C5H10 |
пентен |
C6H12 |
гексен |
Физические свойства
С2 – С4 (газы)
С5 – С18 (жидкости)
С19 … – (твёрдые)
· Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
· Легче воды
· С увеличением Mr температуры плавления и кипения увеличиваются
· ЭТИЛЕН - в природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом.
Химические свойства
В отличие от насыщенных углеводородов для углеводородов ряда этилена характерны разнообразные реакции присоединения по месту двойной связи; при этом они значительно легче вступают во взаимодействие с различными реагентами.
Реакции присоединения:
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
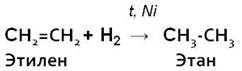
2. Галогенирование (взаимодействие с галогенами):
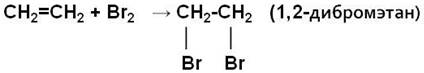
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Реакция полимеризации:
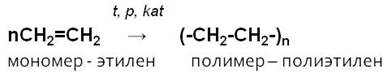
Благодаря двойной связи молекулы алкенов могут соединяться между собой, т. е. полимеризоваться.
Как и предельные углеводороды, алкены горят на воздухе:
C2H4 + 3O2 t→ 2CO2 + 2H2O + Q (пламя ярко светящее)
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена

Этилен - исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этилена, являющихся основой ряда синтетических смазочных масел.

Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
3. Домашнее задание
П. 52, упр. 8-10, задача 2 на стр. 163.