Настольная книга учителя по химии 9 класс - поурочные разработки
Коррозия металлов - Металлы
Цели урока. Дать понятие о коррозии металлов, классификации коррозионных процессов и способах защиты от коррозии.
Оборудование и реактивы — перечислены по ходу эксперимента, используемого на уроке, в том числе и поставленного заранее, за 2—3 дня до этого урока.
I. Коррозия металлов
Эта часть урока проводится в форме эмоционального рассказа учителя и преследует цель дать общее представление о коррозии и о вреде, наносимом этим явлением.
Учитель демонстрирует фотографии с символами различных городов мира: Кремль — это символ Москвы, статуя Свободы и небоскребы — символы Нью-Йорка, шпили — символы Санкт-Петербурга, а Эйфелева башня — символ Парижа.
Но башня неизлечимо больна — она изготовлена из обычной стали и неотвратимо ржавеет и разрушается, и только постоянная химиотерапия (лечение химическими веществами) помогает бороться с этим смертельным недугом: Эйфелеву башню красили уже 18 раз, отчего ее масса (9000 т) каждый раз увеличивалась на 70 т.
Коррозия наносит не только прямой ущерб (ежегодно от нее теряется около трети произведенного за год во всем мире металла), но и косвенный: ведь разрушаются конструкции, на которые тоже был затрачен труд (машины, крыши, памятники, мосты), тратятся огромные средства на борьбу с этим явлением.
Что же такое коррозия, какие факторы определяют ее протекание?
II. Роль кислорода воздуха в коррозии железа
Учитель демонстрирует результаты поставленного заранее (за 2—3 дня) эксперимента (по одному или по двум вариантам).
Вариант 1. Наливают в две пробирки воды. В одной из них воду кипятят. Помещают в обе пробирки по очищенному наждачной бумагой железному гвоздю. Плотно закрывают пробирки резиновыми пробками, чтобы предотвратить новое растворение кислорода в прокипяченной воде.
Наблюдают, в какой из пробирок быстрее произойдет коррозия железа.
Вариант 2. Собирают прибор по рисунку (рис. 13). Помещают в колбу, смоченную водой, железные стружки (лучше порошок железа). Закрывают колбу пробкой с газоотводной трубкой.
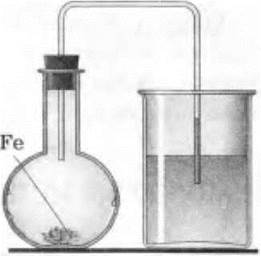
Рис. 13. Влияние кислорода воздуха на процесс ржавления железа
Проверяют герметичность прибора. Конец газоотводной трубки помещают в стакан с подкрашенной водой.
Наблюдают поднятие воды в трубке. Предлагают учащимся объяснить это явление.
Опыты наглядны, отличаются простотой оборудования и постановки, дают возможность убедиться в том, что кислород воздуха оказывает огромное влияние на процесс коррозии, являясь одним из наиболее агрессивных ее факторов.
Перед демонстрацией результатов опытов следует вспомнить состав воздуха, выяснить, какие его составные части способствуют коррозии металлов.
Для следующей демонстрации не требуется предварительной постановки опытов. Будет хорошо, если учитель заложит его в начале урока, так как 10—15 минут достаточно, чтобы получить результаты.
III. Коррозия железа в различных электролитах
Реактивы: 10%-ный раствор едкого натра, дистиллированная вода, пять железных гвоздей, реактив на ионы железа — 1%-ный раствор красной кровяной соли.
Посуда и другое оборудование: штатив для пробирок, пять пробирок.
Наливают в пять пробирок на 1/3 их объема: в 1-ю пробирку — раствор гидроксида натрия, во 2, 3, 4-ю — раствор хлорида натрия, в 5-ю — кипяченую воду.
Одновременно опускают в 1, 2, 5-ю пробирки по железному гвоздю, в 3-ю — гвоздь в контакте с медной проволокой, в 4-ю — гвоздь в контакте с цинком (рис. 14).

Рис. 14. Коррозия железа в растворах электролитов и при контакте с другими металлами
Спустя 10—15 мин вынимают гвозди и обнаруживают в растворах ионы железа, приливая во все пробирки по нескольку капель раствора красной кровяной соли.
Предлагают учащимся объяснить наблюдаемые явления. Данный опыт знакомит с коррозией металлов в условиях соприкосновения их с различными электролитами — солями, щелочами, — и с влиянием контакта с другими металлами на процесс коррозии.
И наконец, для того чтобы учащиеся получили представление о том, что коррозия — это универсальное явление не только для железа, но и для всех металлов, а также о том, что она протекает при наличии двух условий:
1) электропроводной среды;
2) контакта двух различных по положению в ряду напряжений металлов;
учитель в начале урока закладывает еще одну серию опытов. Реактивы: две алюминиевые проволочки, два железных гвоздя, медная и цинковая проволока, 3%-ный раствор поваренной соли, фенолфталеин.
Посуда и другое оборудование: штатив для пробирок, семь пробирок; белый фон, наждачная бумага.
Наливают в семь пробирок на 1/3 объема раствор поваренной соли. Прибавляют в каждую пробирку по 2—3 капли фенолфталеина. Помещают в пробирки тщательно зачищенные кусочки металлов: в 1-ю — алюминия; во 2-ю — железа; в 3-ю — меди; в 4-ю — цинка; в 5-ю — алюминия, обвитого медной проволокой; в 6-ю — железа, обвитого медной проволокой; в 7-ю — цинка, обвитого медной проволокой.
Наблюдают появление розового окрашивания, отмечают, где оно появляется быстрее. Делают выводы. Разбирают электрохимический процесс гальванических пар в каждом отдельном случае. Отмечают, какой металл разрушается, на каком выделяется водород; в каком случае происходит наиболее быстрое накопление гидроксильных ионов.
Анализ результатов последней серии опытов дает учителю возможность перейти к следующей части урока — к рассмотрению различных видов коррозии, т. е. к ее классификации.
IV. Виды коррозии металлов
Эта часть урока проводится в форме обобщающей беседы и сопровождается записью опорного конспекта.
Химическая коррозия металлов — это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды.
Наиболее распространенным видом химической коррозии является газовая коррозия, проистекающая в сухих газах при полном отсутствии влаги. Газообразное вещество окружающей среды реагирует с металлом на поверхности металлического изделия и образует с ним соединения (в качестве примера учитель может рассмотреть различные химические процессы, протекающие на поверхности щелочного или щелочноземельного металла, лишенного керосиновой защиты). Если продукты такого взаимодействия нелетучи и образуют плотную пленку (как, например, у алюминия), то коррозия со временем уменьшается и может совсем прекратиться. Если же образуется рыхлая пленка, то коррозия может привести к полному разрушению металла (как у железа и его сплавов).
Кислородная коррозия стали связана с образованием оксидной пленки, состоящей из FeO, Fe2О3, Fe3О4.
Взаимодействие стали с водородом сопровождается выделением образующегося при этом метана и приводит к изменению структуры металла. Этот процесс называется обезуглероживанием стали. Он очень опасен для аппаратов, работающих под давлением при высоких температурах, например колонн синтеза аммиака.
Чтобы перейти к рассмотрению другого типа коррозии, учитель рассказывает о том, что еще в Древнем Египте было замечено, что латунные изделия (сплав меди и цинка) со временем покрываются слоем губчатой меди, а цинк окисляется. В средние века было распространено отбеливание монет из сплава меди с серебром в растворе винного камня, при этом медь растворялась, а на поверхности монеты оставалось серебро. И наконец, с конца XIX в. до настоящего времени остро стоит проблема обезцинкования латуней конденсаторных трубок теплообменных установок.
Электрохимическая коррозия — это разрушение металлов, которое сопровождается возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (отдача электронов атомами корродируемого металла — процесс окисления) протекают электрические (перенос электронов от одного участка изделия к другому).
По характеру разрушения металла различают коррозию сплошную и местную.
Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами).
При местной коррозии ее очаги распределяются неравномерно — в виде коррозионных пятен или точек, что особенно опасно для промышленной химической аппаратуры.
Глубокое поражение материала с небольшой внешней поверхностью разрушения называется коррозийной язвой или питтингом.
Интеркристаллитная коррозия распространяется по границам кристалла в глубь металла (например, обезуглероживание стали).
Экстрактивная коррозия — это удаление одного из компонентов сплава (например, выщелачивание цинка из латуни).
Все типы и виды коррозии можно представить с помощью схемы 1.
Схема 1
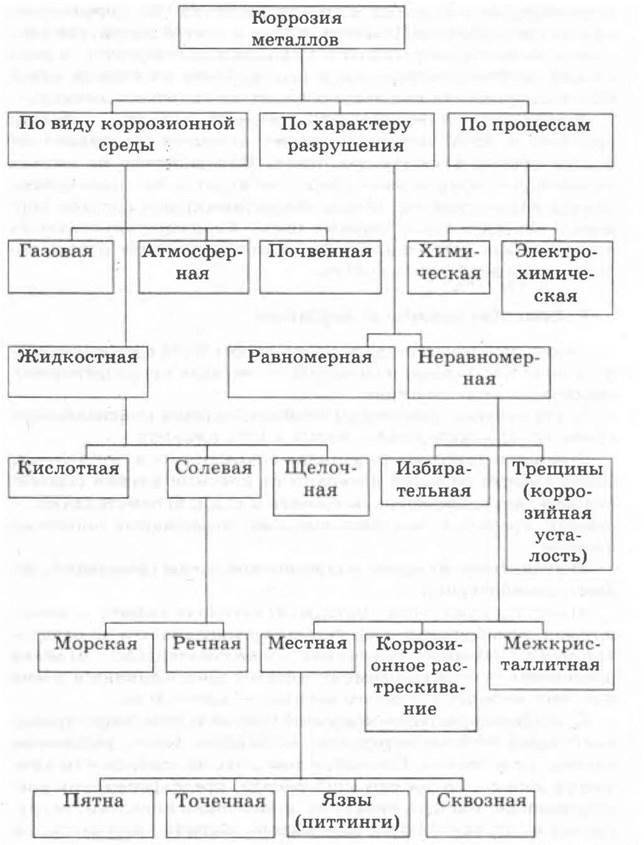
Коррозия многолика. Пусть в ничтожных количествах, но почти любой металл содержит примеси. Поэтому разрушение часто носит локальный характер, начинаясь там, где находится скопление примесей. Особенно опасно это стало в последние годы, когда условия эксплуатации по сравнению с тридцатыми—сороковыми годами XX в. стали жестче, суровее. Коррозионное растрескивание недопустимо в изделиях очень многих отраслей промышленности — авиационной, химического и атомного машиностроения, нефтяного машиностроения.
Если среда электропроводна, а это бывает почти всегда, то на поверхности металла протекают электрохимические реакции: на аноде идет окисление металла, на катоде — восстановление.
Очень интенсивно протекает коррозия в тех случаях, когда два различных металла находятся в электрическом контакте с поверхностной пленкой атмосферной влаги, которая служит электролитом.
С увеличением глубины концентрация кислорода в воде уменьшается. Это значит, что на определенной глубине на находящемся в воде металле, например на обшивке корпуса корабля, будет достигнуто равновесие реакции восстановления кислорода. Поверхность, находящаяся ближе к ватерлинии, поведет себя в этом случае как катод, а та, что глубже, — как анод, на котором металл и начнет разрушаться.
Такая же ситуация складывается и в трубопроводах, если концентрация кислорода в грунте различна. На поверхность металла попадает капля влаги, тотчас в центре капли, где кислорода мало, металл становится анодом и растворяется, а роль катода начинают играть края капли, более доступные влиянию кислорода. На них будет осаждаться гидроксид металла.
В городах, где имеется сеть трамвайных линий, кабелей, проводов и труб, металл разъедает коррозия, возникающая под действием блуждающих токов. При действии на металл активаторов, вроде ионов хлора, начинается так называемая питтинговая коррозия. Очень опасна межкристаллитная коррозия; она идет вдоль сварных швов. Коррозию увеличивают механическая нагрузка, трение, высокие скорости потока воды в канализационных трубах.
V. Способы защиты от коррозии
Обобщение по этой части урока может быть сформулировано в виде следующих положений — методов предупреждения коррозии и защиты от нее;
1) применение химически стойких сплавов (нержавеющие стали, содержащие до 18% хрома и 10% никеля);
2) защита поверхности металла покрытиями: а) металлами, образующими на своей поверхности прочные пленки (хромирование, никелирование, золочение и т. д.); б) неметаллами — лаками, красками, эмалями, смолами, создающими защитные пленки;
3) подавление влияния коррозионной среды (деаэрация, добавка ингибиторов);
4) электрохимические методы: а) катодная защита — защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электроэнергии; б) метод протектора — к защищаемому металлу присоединяется кусок или лист из более активного металла — протектора.
Для предотвращения коррозии ученые и инженеры применяют более стойкие материалы: алюминий, титан, различные сплавы, пластмассы. Благодаря тому, что на поверхности алюминия образуется тонкий слой оксида, предохраняющий расположенный под ним металл от дальнейшей коррозии, разрушается он не так быстро, как железо. Магний тоже защищен от коррозии пленкой оксида. Хорошая защитная пленка образуется на поверхности сплава железа с хромом. Эти сплавы и есть всем известная нержавеющая сталь. Из ее листов собрана знаменитая скульптура Мухиной «Рабочий и колхозница» у северного входа на ВВЦ в Москве. А находящийся неподалеку от нее, у вестибюля метро, монумент в честь покорения космоса, сделанный в виде 99-метрового шлейфа, изготовлен из отшлифованных до блеска листов титана. Он простоит сотни лет. Из титана сделан и памятник Юрию Гагарину в Москве.
Металлурги создали десятки легированных сплавов, медленно поддающихся коррозии, а химики — десятки способов уменьшения количества веществ, вызывающих коррозию в тех средах, где приходится находиться металлическим конструкциям. Для защиты оборудования изобретены особые вещества — ингибиторы, уменьшающие коррозию в сотни и тысячи раз. Это органические соли и кислоты, амины, хроматы, фосфаты. Чтобы уберечь металлические поверхности от ржавчины, их покрывают органическими и неорганическими веществами, красками, лаками, анодируют, фосфатируют, оксидируют, хромируют. Изделия из железа оцинковывают. Если цинковое покрытие разрушается, возникает гальваническая пара: цинк становится анодом, железо — катодом и тогда коррозионному процессу подвергается цинк, а на железе идут восстановительные процессы и его разрушение начинается лишь после того, как прокорродирует весь цинк.
Об этих тонкостях хорошо знают кровельщики. Покрытие изделий металлами с помощью электролиза — гальваностегия — один из эффективных и эстетичных способов защиты от коррозии.
Чтобы предохранить изделия от коррозии, их покрывают цинком, кадмием, оловом, свинцом, никелем, железом, кобальтом. Особенно нуждается в этом химическая и электротехническая аппаратура. Цинкование, лужение, свинцевание — неотъемлемые звенья многих технологических цепочек.
Никелевые покрытия нарядны, стойки, прочны. Поэтому никелирование — самый распространенный в гальванотехнике процесс. Ежегодно во всем мире никелируют миллионы квадратных метров поверхности различных изделий — от дверных ручек до бамперов автомобилей и волноводов. Разработаны специальные электролиты и оптимальные токовые режимы, благодаря которым никелирование производится
быстро и надежно. Точно так же хромируют цилиндры двигателей, лопатки паровых турбин и другие изделия, которые должны противостоять сильному жару, износу, агрессивной среде.
В качестве демонстрационного эксперимента учитель может показать результаты следующих опытов.
1. Защита металлов от коррозии с помощью ингибитора
Наливают на 1/5 объема пробирки разбавленную серную кислоту. Помещают в пробирку с кислотой железные стружки (можно заменить их цинковыми) и нагревают содержимое пробирки почти до кипения. Наблюдают выделение водорода и растворение железных стружек. Добавляют в пробирку ингибитор уротропин (1 измельченную таблетку), который можно заменить тиомочевиной или сухим горючим. Отмечают прекращение выделения водорода.
2. Искусственное нанесение оксидной пленки на железо (пассивация железа в азотной кислоте)
Реактивы: концентрированная азотная кислота (свежеприготовленная), два железных гвоздя, 10—20%-ный раствор серной кислоты, вода.
Посуда и другое оборудование: две пробирки, наждачная бумага.
Тщательно зачищают наждачной бумагой железный гвоздь. Наливают концентрированную азотную кислоту в пробирку на 1/3 ее объема. Обращают внимание на меры предосторожности при работе с концентрированной азотной кислотой. Осторожно помещают в пробирку с азотной кислотой на 1—2 минуты гвоздь. Гвоздь не бросать! Наблюдают покрытие его оксидной пленкой (пассивирование). Промывают гвоздь водой для удаления следов азотной кислоты. Проверяют коррозионную устойчивость пассивированного гвоздя:
а) опускают пассивированный и, для сравнения, непассивированный гвозди в разбавленный раствор серной кислоты. Делают наблюдения и выводы о взаимодействии того и другого гвоздя с серной кислотой;
б) наблюдают, через какой промежуток времени начнет корродировать пассивированный гвоздь — в обычной атмосфере и во влажной атмосфере. (С пассивированным железом реакции не будет.)