Настольная книга учителя по химии 9 класс - поурочные разработки
Генетические ряды металлов - Металлы
Цели урока. На основе общего (генетические ряды металлов), особенного (генетические ряды металлов, которым соответствует: а) щелочь; б) нерастворимое основание; в) амфотерные оксид и гидроксид) и единичного (генетические ряды конкретных металлов) повторить, обобщить и систематизировать знания учащихся о генетической связи между классами неорганических соединений. Закрепить понятие о качественных реакциях на примере их для Na+, Li+, Са2+, Fe2+ и Fe3+.
Оборудование и реактивы. Zn, Li, Na, Са, Сu, Fe, Аl металлические; растворы: фенолфталеина, HNO3, НСl, H2SO4, K3[Fe(CN)6], K4[Fe(CN)6], KNCS или NH4NCS, Na3PO4 или H3PO4, AlCl3, КОН; пробирки, прибор для получения газов, горелка или спиртовка, заточенный на 1—1,5 см графитовый карандаш.
I. Повторение общих представлений о генетической связи
Эта, вводная, часть урока проводится учителем в форме беседы на основе уже имеющихся у учащихся сведений из курса 8 класса и введения в 9 класс.
Основные тезисы этой части урока могут быть сформулированы так.
1. Генетическая связь — это более общее (родовое) понятие, которое отражает взаимные превращения разных форм существования разных химических элементов.
2. Генетический ряд — это более узкое (видовое) понятие, которое отражает взаимопревращения разных форм существования одного химического элемента.
3. Основными признаками генетической связи и генетического ряда являются:
• принадлежность веществ к разным классам соединений;
• эти вещества связаны взаимопревращениями;
• эти вещества образованы одним (для генетического ряда) или несколькими (для генетической связи) элементами, т. е. представляют собой разные формы существования химических элементов.
Учащиеся сами называют типы генетических рядов в неорганической химии:
• генетический ряд металла;
• генетический ряд неметалла, известные им из курса 8 класса и еще один:
• генетический ряд элемента, которому соответствуют амфотерные оксид и гидроксид, с которыми они познакомились в начале, во вводной части, курса 9 класса.
Учитель уточняет, что последний ряд образуют переходные металлы (металлы побочных подгрупп), а также бериллий и алюминий. Поэтому, подчеркивает он, на этом уроке будут рассмотрены также и ряды, образованные этими элементами, и просит учащихся вспомнить, какие виды генетических рядов металлов они изучили в 8 классе. Учащиеся называют:
• генетический ряд металлов, которым соответствуют щелочи, т. е. щелочных и щелочноземельных металлов, и
• генетические ряды металлов, которым соответствуют нерастворимые основания.
II. Генетические ряды металлов, которым соответствуют щелочи
Этот вид рядов учитель предлагает рассмотреть на примере щелочных металлов — лития и натрия и щелочноземельного металла кальция.
1. Генетические ряды лития и натрия могут быть рассмотрены с помощью следующих цепочек превращений:
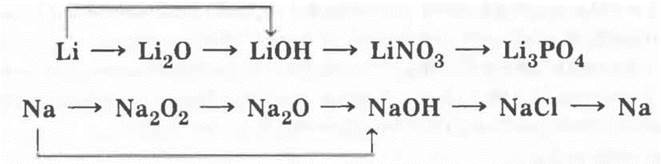
Затем учитель демонстрирует эти превращения. Описание техники и методики проведения эксперимента было дано в уроках по щелочным металлам. Здесь следует лишь уточнить, что для ряда натрия учитель не покажет перехода пероксида в оксид и электролиза хлорида натрия.
На этом этапе урока учитель просит учащихся сравнить знания об этом виде генетического ряда металла, полученные ими в 8 классе, со знаниями по 9 классу. Ребята легко справятся с этим заданием: в 8 классе этот вид генетического ряда был представлен в неполном виде (он заканчивался солью), а в 9 — полно.
2. Рассмотрение генетического ряда кальция позволит дать понятие о жесткости воды и способах ее устранения.
![]()
Эксперимент по этим переходам для учителя не составит сложности.
III. Генетические ряды металлов, которым соответствуют нерастворимые гидроксиды
Этот этап урока учитель может начать с рассмотрения и демонстрации эксперимента по хорошо известному девятиклассникам генетическому ряду меди:
![]()
Техника и методика этого эксперимента также не представляют трудностей. Укажем только, что учитель демонстрирует учащимся нагревание полученного синего осадка гидроксида меди (II) и изменение цвета на черный из-за образовавшегося оксида меди (II), но для заключительного перехода использует не образовавшийся оксид, а имеющийся в кабинете гранулированный.
В сухую пробирку помещают 1—2 гранулы черного оксида меди (II), к которым вплотную приближают кончик газоотводной трубки прибора для получения газов, заряженного концентрированной соляной кислотой и гранулами цинка. Дно пробирки с оксидом меди (II) подогревают снаружи пламенем горелки или спиртовки. Через 2—3 мин дно пробирки покрывается изнутри красивым медным зеркалом, а на ее стенках появляются капельки воды.
Рассмотрение генетического ряда железа позволит развить представления учащихся о генетическом ряде металла, ведь в этом ряду один элемент имеет разные степени окисления:
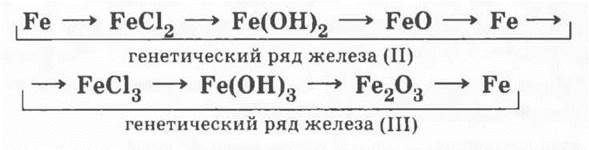
Учителю при рассмотрении этого ряда можно не проводить эксперимента, иллюстрирующего все превращения, но следует обязательно показать качественные реакции на Fe2+ и Fe3+.
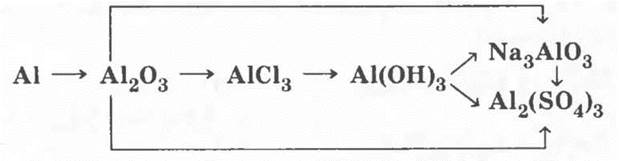
IV. Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид
Этот генетический ряд был подробно рассмотрен во введении. Экспериментальное выполнение его у учителя не вызовет затруднений.
V. Качественные реакции на ионы металлов
Учитель просит учащихся дать определение понятий «качественная реакция» и «реактив» на определяемое вещество или ион. Он обращает внимание учащихся, что для ионов лития Li+реактивом может служить растворимая соль фосфорной кислоты, так как фосфат лития малорастворим: при приливании к раствору, например, нитрата лития раствора фосфата натрия выпадает осадок:
![]()
А вот для ионов натрия подобная реакция отсутствует — все соли натрия растворимы. Учащиеся сами указывают способ обнаружения ионов Na+ — окрашивание пламени в желтый цвет.
Заточенный графитовый карандаш с грифелем длиной 1—1,5 см опускают в концентрированную азотную кислоту, хорошо прокаливают. После этого опускают кончик графита в раствор какой-либо соли натрия (калия, лития) и вносят в бесцветное пламя спиртовки или горелки:
Li+ — окрашивает пламя в малиновый цвет;
Na+ — в желтый;
К+ — в фиолетовый (смотреть на него лучше через синее стекло).
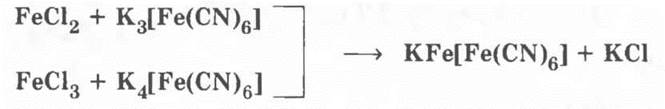
Для ионов Fe3+ реактивов — два: роданид аммония или калия:

и желтая кровяная соль K4[Fe(CN)6].
Для ионов Fe2+ реактивом служит красная кровяная соль K3[Fe(CN)6]. В двух последних реакциях выпадает одинаковый синий осадок:
По ходу урока учитель требует от учащихся рассмотрения уравнений реакций в ионном виде и в свете окислительно-восстановительных реакций там, где это имеет место.