Настольная книга учителя по химии 9 класс - поурочные разработки
Угольная кислота и ее соли - Неметаллы
Цели урока. Повторить соли средние и кислые на примере карбонатов и гидрокарбонатов. Познакомить учащихся с характерными свойствами солей угольной кислоты и их представителями. Показать взаимосвязь двух рядов солей на примере переходов карбонатов в гидрокарбонаты и обратно. Рассмотреть жесткость воды и способы ее устранения.
Оборудование и реактивы. Мрамор, НСl, известковая вода, лакмус, разрыхлители теста, NaHCO3 и Na2CO3 (крист. и раствор), СаСl2 (р-р), Na3PO4, ионообменники. Прибор для получения газов, пробирки, горелка, спички, держатель для пробирок, чайник или обрезок трубы центрального отопления с накипью, раствор мыла.
I. Угольная кислота
Вначале учитель просит ребят дать полную характеристику этой кислоты: кислородная, двухосновная, слабая, непрочная, а потому — летучая.
Существует только в растворе, при нагревании или стоянии разлагается.
Учитель демонстрирует пропускание углекислого газа через налитую в пробирку воду, подкрашенную лакмусом, — через некоторое время лакмус краснеет из-за получившейся кислоты. Однако стоит раствор подогреть, как лакмус снова становится фиолетовым.
Учитель говорит о том, что когда пьют любой газированный напиток, то пьют в какой-то мере растворы угольной кислоты, которая благополучно разлагается в желудке.
II. Соли угольной кислоты и их свойства
Как двухосновная, угольная кислота образует два ряда солей:
1) средние — карбонаты, с остатком СО32-;
2) кислые — гидрокарбонаты, с остатком НСO3-.
Вначале учитель актуализирует те знания о свойствах солей, которые необходимо знать. Первое касается растворимости: растворимы все гидрокарбонаты и из карбонатов только — соли К+, Na+ и NH4+.
Второе — общие химические свойства.
1. Все соли угольной кислоты разлагаются:
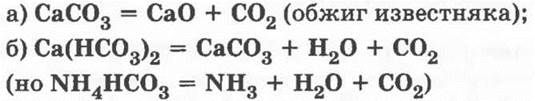
2. Все соли взаимодействуют с кислотами — дают качественную реакцию на ионы СО32- и НСO3-:
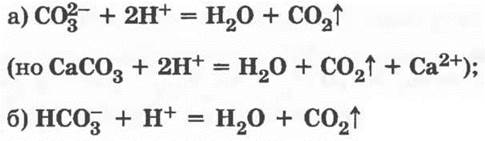 (демонстрация или лабораторная работа).
(демонстрация или лабораторная работа).
3. Карбонаты превращаются в гидрокарбонаты при избытке углекислого газа и воды и обратно, при нагревании
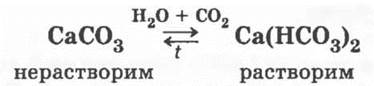
Идет демонстрация помутнения известковой воды с последующим растворением выпавшего осадка при дальнейшем пропускании СO2 через мутный раствор, и новое появление осадка при нагревании ставшего прозрачным раствора.
Другие свойства карбонатов и гидрокарбонатов будут обусловлены катионами образующих их металлов.
III. Представители солей угольной кислоты
Этот материал учащиеся рассматривают в ходе самостоятельной работы с текстом учебника.
IV. Жесткость воды и способы ее устранения
Очень важная в дидактическом плане часть урока, которая позволит учителю повторить и обобщить материал не столько по химии углерода, сколько по теории электролитической диссоциации.
Учитель подчеркивает, что вода называется жесткой, если она содержит катионы Са2+ и Mg2+, т. е. растворимые соли этих металлов.
Далее учащиеся работают с таблицей растворимости и определяют, что это могут быть хлориды, сульфаты, нитраты.
Учитель ставит проблему: «А как устранить эти ионы из воды, т. е. сделать ее мягкой?» Учащиеся без труда решают, что их можно удалить в осадок с помощью реакций ионного обмена:
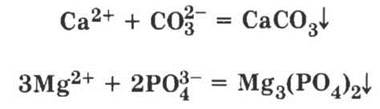
Учитель соглашается, что это возможно и на практике осуществляется путем добавления технической соды для умягчения воды. Одновременно он просит учащихся вспомнить, что растворимыми будут не только некоторые средние соли кальция и магния, но и все кислые соли — гидрокарбонаты. А как известно, при нагревании они превращаются в нерастворимые карбонаты и вода становится мягкой. Такая жесткость воды, которая обусловлена содержанием в ней гидрокарбонатов кальция и магния и устраняется кипячением, называется временной в отличие от постоянной, которая таким способом не устраняется и вызвана содержанием растворимых средних солей этих металлов.
Запись на доске:

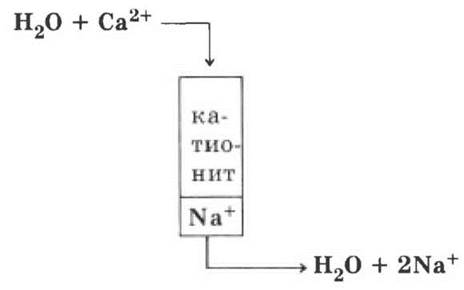
Если позволит время, то можно немного познакомить учащихся с ионитами, принцип действия которых можно показать схематично:
То, какой вред человеку приносит жесткая вода, учитель выясняет с учащимися в ходе беседы.
Для хозяйственно-бытовых нужд требуется вода с незначительной жесткостью. При кипячении жесткой воды образуется накипь. В такой воде плохо развариваются мясо, овощи, крупа, плохо заваривается чай. В жесткой воде мыло плохо пенится, так как соли кальция и магния реагируют с ним, образуя нерастворимые соединения. При стирке тканей эти вещества осаждаются на поверхности нитей и постепенно разрушают волокна.
При использовании в паровых котлах жесткой воды на внутренней поверхности их образуется накипь из карбонатов кальция и магния, сульфата кальция и других солей. Ее образование затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла и даже может привести к взрыву.
Аналогичную картину можно наблюдать и на стенках обычных чайников или внутренней поверхности труб центрального отопления.