Настольная книга учителя по химии 9 класс - поурочные разработки
Предельные одноосновные карбоновые кислоты. Сложные эфиры - Органические вещества
Цели урока. На основе реакций окисления альдегидов дать понятие о предельных одноосновных карбоновых кислотах и сложных эфирах, их свойствах и применении. Продолжить формирование представления о генетической связи «... алканаль → алкановая кислота → сложный эфир».
Оборудование и реактивы. Растворы уксусной кислоты, CuSO4, NaOH, металлический цинк, оксид магния, карбонат кальция, спиртовка, индикаторная бумага. Демонстрационные образцы: стеариновая свеча, лимон, яблоко, простокваша или кислое молоко, таблетка аспирина.
I. Карбоновые кислоты
При проверке домашнего задания учитель особое внимание обращает на окисление альдегидов до соответствующих карбоновых кислот. Общность химического строения этих соединений позволяет предположить, что они принадлежат к одному гомологическому ряду. Функциональная группа атомов —COOH называется карбоксильной группой.
Органические соединения, в молекулах которых карбоксильная группа соединена с алкильным радикалом, называются предельными одноосновными карбоновыми кислотами.
Ребятам предлагается расшифровать каждое из прилагательных:
• предельные, так как это производные предельных углеводородов, в которых один атом водорода замещен на карбоксильную группу;
• одноосновные, поскольку содержат одну карбоксильную группу. Понятие основности позволяет провести аналогию между органическими и неорганическими кислотами;
• карбоновые — по названию функциональной (карбоксильной) группы.
Аналогично альдегидам у первого представителя гомологического ряда карбоновых кислот функциональная группа связана с атомом водорода, у последующих — с алкильным радикалом.
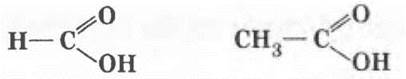
муравьиная (метановая) кислота уксусная (этановая) кислота
Международные названия простейших представителей карбоновых кислот используются химиками редко, зато их легко запомнить. Они образуются от названия предельных углеводородов с тем же числом углеродных атомов, например метановая и этановая кислоты.
Очень интересна этимология тривиальных названий карбоновых кислот. Они указывают на нахождение этих веществ в природе. Муравьиная (метановая) кислота вызывает жжение при укусе муравьев и крапивы, уксусная (этановая) кислота впервые выделена из уксуса, масляная (бутановая) кислота придает прогорклому маслу его типичный запах, капроновая (гексановая) кислота входит в состав козьего жира (от латинского caper — коза). Кстати, тривиальные названия альдегидов происходят именно от названия соответствующих кислот, а не наоборот.
Учитель предлагает ребятам составить общую формулу предельных одноосновных кислот. Сочетание алкильной группы СnН2n+1 и карбоксила —СООН дает нужный результат: СnН2n+1COOH. Но для того чтобы «за бортом» не осталась муравьиная кислота, придется считать возможным n = 0.
Карбоновые кислоты и их производные являются одними из самых распространенных в быту и промышленности органических веществ. Уксусная кислота — одна из первых, известных человеку. Ежедневно мы сталкиваемся с самими карбоновыми кислотами и их производными: мылами, жирами, сложными эфирами.
Благодаря работам шведского химика Карла Шееле (его имя уже упоминалось в курсе) к концу XVIII в. было известно около десятка кислот. Именно ему удалось выделить в чистом виде лимонную, молочную, галловую, щавелевую и другие кислоты. Лишь спустя 100 лет удалось выяснить их состав и строение, а также доказать, что кислоты бывают не только одноосновными, но и многоосновными.
II. Свойства карбоновых кислот
Свойства органических кислот во многом похожи на свойства их неорганических родственников. Только сильные электролиты среди органических веществ — большая редкость. В основном это слабые кислоты и кислоты средней силы.
Учитель объясняет химические свойства органических кислот с использованием демонстрационного эксперимента и проводит аналогию с кислотами неорганическими.
1. Органические кислоты, хотя и являются слабыми электролитами, способны к электролитической диссоциации. В водном растворе их молекулы распадаются на катион водорода и анион кислотного остатка. Именно наличие катиона водорода придает кислотам кислый вкус и специфические химические свойства:

Как известно, определить кислотность среды можно с помощью индикатора. Учитель исследует с помощью полоски универсальной индикаторной бумаги раствор уксусной кислоты и просит ребят сделать вывод.
Органические кислоты содержатся во многих продуктах питания. С помощью индикаторной бумаги учитель демонстрирует наличие кислот в лимонном соке (лимонная кислота), яблоке (яблочная), кислом молоке или простокваше (молочная). Таблетка аспирина, растворенная в воде, имеет сильно кислотную реакцию на индикатор (ацетилсалициловая кислота).
Наличие кислоты во всех исследованных объектах можно обнаружить с помощью собственного «индикатора» — языка (осторожно, не переусердствовать!). Все они имеют кислый вкус. Однако если лизнуть стеариновую свечу (найдите именно такую, а не парафиновую), кислого вкуса не обнаружится. Тем не менее свеча изготовлена из предельной одноосновной карбоновой кислоты, содержащей 17 углеродных атомов в алкильном радикале и неразветвленную углеродную цепочку — стеариновой кислоты С17Н35СООН. Отличить такую свечу от парафиновой можно также с помощью индикатора. Если расплавленным стеарином капнуть на полоску индикаторной бумаги, хорошо заметна красная окраска. В расплавленном состоянии стеариновая кислота диссоциирует!
2. Карбоновые кислоты реагируют с активными металлами. При взаимодействии цинка с уксусной кислотой выделяются пузырьки водорода. Реакция заметно ускоряется при нагревании:

В растворе образуется соль уксусной кислоты. Такие соли называются ацетаты (соли муравьиной кислоты — формиаты). Помимо водорода, продуктом первой реакции является ацетат цинка.
3. Карбоновые кислоты взаимодействуют с основными оксидами. Оксид магния растворяется при добавлении к нему раствора уксусной кислоты, так как протекает химическая реакция:
![]()
Образующуюся соль можно назвать ацетат магния. Аналогично реагируют с основными оксидами неорганические кислоты:
![]()
4. Уксусная кислота способна взаимодействовать с основаниями, причем не только со щелочами, но и нерастворимыми в воде. Если на свежеприготовленный осадок гидроксида меди (II) подействовать раствором уксусной кислоты, осадок исчезает, образуется голубой раствор соли меди. Учащиеся без труда называют эту соль — ацетат меди (II):
![]()
Аналогично:
![]()
5. Карбоновые кислоты хотя и слабые, но сильнее некоторых неорганических, например угольной. Поэтому уксусная кислота способна вытеснять угольную из ее солей — карбонатов. Если в пробирку с порошком карбоната кальция добавить раствор уксусной кислоты, наблюдается бурное выделение углекислого газа в соответствии с реакцией обмена:

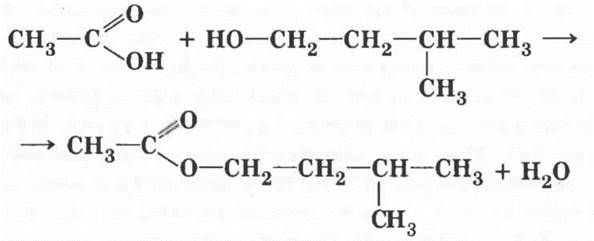
6. Одно из самых замечательных свойств карбоновых кислот — их взаимодействие со спиртами. Эту реакцию в 1873 г. изучал выдающийся русский химик Владимир Васильевич Марковников, практическое ее осуществление было усовершенствовано немецким ученым Эмилем Фишером. Учитель демонстрирует реакцию получения сложного эфира. Методика, описанная в учебнике, разработана именно Марковниковым! Если в лаборатории есть изоамиловый спирт (3-метилбутанол-1), реакция с ним гораздо эффектнее. Образующийся сложный эфир имеет интенсивный запах груши, это грушевая эссенция.
Учитель дает определение реакции этерификации и записывает на доске ее уравнение.
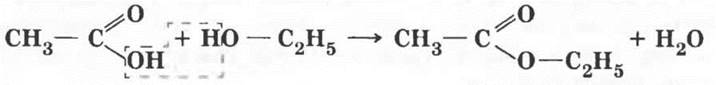
Учащиеся третьего уровня могут попробовать написать уравнение реакции этерификации уксусной кислоты с изоамиловым спиртом.
Сложным эфирам повезло с названиями. По международной номенклатуре продукт первой реакции называют аналогично солям: этилацетат. Возможны названия: уксусно-этиловый эфир и этиловый эфир уксусной кислоты.
Сложные эфиры широко распространены в природе. Именно они придают многим цветам, фруктам и ягодам их неповторимый аромат. Даже кислоты с неприятным запахом после этерификации образуют приятно пахнущие эфиры.