Настольная книга учителя по химии 9 класс - поурочные разработки
Аминокислоты и белки - Органические вещества
Цели урока. Дать представление об аминокислотах как амфотерных органических соединениях; сравнить их с неорганическими амфотерными гидроксидами. На основе реакции поликонденсации познакомить учащихся с полипептидами — белками. Рассмотреть свойства и биологическую роль последних.
Оборудование и реактивы. Растворы NaOH, CuSO4, NH3, лимонной кислоты, яичного белка, концентрированная HNO3. Демонстрационные образцы: бульон мясной или рыбный, яйцо вкрутую, бульонный кубик «Галина Бланка», шерстяная нитка, плакаты с изображениями первичной, вторичной и третичной структуры белка.
I. Строение аминокислот
Учитель напоминает ребятам, что, помимо углерода и водорода, в состав органических веществ могут входить атомы кислорода (учащиеся вспоминают названия гидроксильной, карбонильной и карбоксильной групп, классы кислородсодержащих органических соединений), а также азота. Как и кислород, азот является составной частью нескольких функциональных групп, среди которых важнейшей является аминогруппа —NH2. Если аминогруппа соединена с углеводородным радикалом, такие вещества называются амины, среди которых наиболее важны амины с общей формулой R—NH2. Эти соединения очень интересны и полезны, однако наибольшее значение имеют органические вещества, содержащие в одной молекуле сразу две функциональные группы: карбоксильную группу —СООН и аминогруппу —NH2. Это одни из самых главных веществ живой природы, которые называются аминокислоты. Учитель изображает на доске общую формулу α-аминокислот и структурную формулу простейшей из них — глицина (аминоуксусной кислоты).

В качестве занимательного момента на уроке он может привести коротенькую историческую справку.
Именно глицин был первой аминокислотой, обнаруженной учеными в природных объектах. Это случилось в 1820 г. благодаря усилиям французского химика Анри Браконно. После длительной обработки кожи, хрящей и сухожилий животных он получил некоторое количество белого кристаллического вещества, имеющего сладкий вкус. Вещество получило название гликокол — «клеевой сахар». Через четверть века был установлен состав этого вещества, получившего к тому времени свое современное название — глицин.
Учитель просит ребят проанализировать формулу этой кислоты и приводит их к выводу, что аминоуксусную кислоту можно рассматривать как производное уксусной кислоты, в которой один атом водорода замещен на аминогруппу. А ведь можно посмотреть на молекулу и с другой стороны, как на производное аммиака, в молекуле которого атом водорода замещен на остаток уксусной кислоты. Однако осуществить превращение уксусной кислоты в аминоуксусную в одну стадию невозможно. Приходится идти «в обход», что и демонстрирует учитель записью на доске.

Учитель просит ребят вспомнить, какую реакцию на индикатор имеет раствор аммиака. Щелочную — это основание. А раствор уксусной кислоты? Естественно, кислотную. Сохраняют ли свои свойства карбоксил и аминогруппа, находясь в одной молекуле? Оказывается, что да! К такому выводу ученые пришли еще в середине XIX в., хотя к тому времени было известно всего четыре аминокислоты. Сочетание кислотных и основных свойств позволяет отнести аминокислоты к амфотерным соединениям. Учитель просит учащихся вспомнить, какие неорганические вещества проявляют амфотерные свойства. Наиболее близка аналогия с амфотерными гидроксидами, которые в зависимости от условий могут вести себя и как кислоты, и как основания.
В настоящее время известно около 150 природных аминокислот, но только немногим более 20 из них являются важнейшими, так как из них построены главные «молекулы жизни» — белки.
II. Полипептиды и белки
Учитель напоминает учащимся о том, что в молекулах аминокислот содержится две функциональные группы: карбоксильная и аминогруппа. Такие соединения в органической химии называются бифункциональными. Оказывается, что две функциональные группы аминокислот способны взаимодействовать друг с другом. Внутри одной молекулы такое взаимодействие затруднено в силу пространственной удаленности так же, как проблематично укусить свой собственный локоть. Зато две молекулы аминокислоты без труда образуют «двойную» молекулу за счет отщепления молекулы воды. Получающееся при этом вещество называют дипептидом.

Два остатка аминокислоты в полученном веществе связаны между собой посредством группы —СО—NH—, которая называется пептидной связью. Отсюда и происходит название пептидов.
Нетрудно заметить, что в дипептиде, как и в аминокислоте, имеется по одной свободной функциональной группе —СООН и —NH2. Следовательно, он может удлинять цепочку в обе стороны за счет конденсации с другими молекулами аминокислот. Образуется полимерная молекула — полипептид. В результате образования такой макромолекулы происходит выделение побочного продукта — воды. Такие реакции носят название поликонденсации.
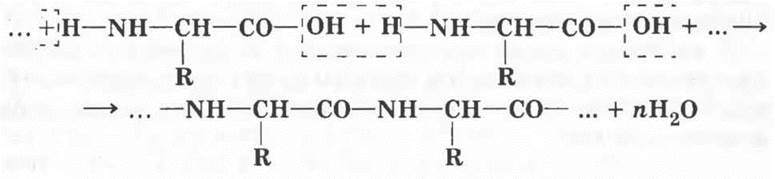
Природные полимеры, состоящие из большого числа остатков аминокислот, называются белками. Слово белок имеет славянское происхождение. Какое отношение оно имеет к особой группе органических веществ? Когда в XIX в. обнаружилось, что белки — главные компоненты живых клеток, все проявления жизни стали связывать только с ними. Символом начала жизни всегда было яйцо. Вот почему белок птичьих яиц дал название всему классу веществ. Во многих иностранных языках белки называют протеинами от греческого слова protos — первый.
Ни одно вещество химики не изучали так долго, как белки, прежде чем удалось разгадать тайну их строения. В 1728 г. итальянский ученый Я. Беккари получил первый очищенный белок — клейковину пшеницы. Через 100 лет А. Браконно выделил основное звено строения белков — аминокислоту. С 1836 г. к исследованию белков подключился известный голландский врач и химик Г. Мульдер. Он обнаружил белковые молекулы во всех исследованных живых организмах, установил сходство состава белков различного происхождения и пришел к выводу, что белок «без сомнения, важнейшее из всех известных тел органического царства, и без него, кажется, не может быть жизни на нашей планете».
К началу XX в. гидролизом белков было получено 13 аминокислот. Пептидную теорию строения белков высказал в 1899 г. выдающийся немецкий химик-органик Эмиль Фишер. Чтобы доказать правильность этой теории, Фишер стремился синтетическим путем получить полипептиды из аминокислот. В 1907 г. эти попытки завершились полным триумфом: ученому удалось получить полипептид из 18 остатков аминокислот! Эмиль Фишер был третьим ученым в мире, дважды удостоенным Нобелевской премии.
Итак, из двух десятков аминокислот построено все многообразие белковых молекул любых живых организмов от вирусов до человека. Естественно, что в одной молекуле белка различные остатки аминокислот повторяются многократно, число возможных изомеров настолько велико, что эти величины трудно себе представить. Например, если полипептид состоит из 20 остатков аминокислот, для него может существовать 2 432 902 008 178 640 000 изомеров. За счет различного числа аминокислотных остатков в молекуле молекулярная масса белков колеблется в широких пределах: от 6500 (инсулин) до 32 миллионов (белок вируса гриппа). Последовательность аминокислотных остатков в молекуле белка называется его первичной структурой.
Подробно останавливаться на вторичной, третичной, четвертичной структурах белка на данном этапе нет необходимости. О них учитель лишь упоминает, демонстрируя имеющийся в наличии материал: масштабную модель, стандартный плакат или рисунок в учебнике.
III. Свойства белков
Объяснение свойств белков учитель сопровождает несложным демонстрационным экспериментом.
1. По способности растворяться в воде белки подразделяются на глобулярные (растворимые) и фибриллярные (нерастворимые). Такое различие по отношению к воде необходимо белкам для выполнения различных функций в организме. Учитель демонстрирует растворение яичного белка в воде, готовя раствор для последующих опытов. Белки шерсти, покровных тканей, ногтей, перьев являются фибриллярными и в воде не растворяются. Глобулярные белки набухают в воде, связывая значительное ее количество, такие плотные коллоидные структуры определяют форму тела.
2. При химическом или термическом воздействии структура белка может разрушаться, белок выделяется из раствора (сворачивается). Этот процесс называется денатурацией. При нагревании пробирки с раствором яичного белка в ней появляются белые хлопья. Молоко содержит значительное количество белка — казеина. При добавлении в молоко нескольких капель раствора лимонной кислоты белок сворачивается. Тот же процесс происходит и при скисании молока, поскольку при этом также образуется кислота — молочная.
3. Как обнаружить присутствие белка в растворе? Для этого существует несколько цветных реакций. Учитель демонстрирует наличие белка в мясном бульоне с помощью биуретовой реакции. Ксантопротеиновая реакция пригодна для обнаружения белка не только в растворе. При неосторожном обращении с азотной кислотой от попадания ее на кожу остается желтое пятно. Это ксантопротеиновая реакция с покровными тканями. Если очистить участок сваренного вкрутую яйца от скорлупы и нанести на белок каплю концентрированной азотной кислоты, отчетливо проявляется желтая окраска.
4. При горении белки издают характерный запах «жженого рога». В этом легко убедиться, если поджечь шерстяную нитку или пучок шерсти (волос). Учитель обращает внимание, что таким образом можно отличить натуральный мех от искусственного, синтетические ткани от шерстяных.
IV. Белки в природе
Белки — это вещества жизни. Каждый живой организм содержит большое количество различных белковых молекул, при этом каждому виду присущи особые, свойственные только ему белки. Даже белки, выполняющие у различных видов одну и ту же функцию, отличаются друг от друга. Например, у всех позвоночных животных — рыб, птиц, млекопитающих — красные клетки крови содержат белок гемоглобин, переносящий кислород. Но гемоглобин у каждого вида животных свой, особенный. Молекула гемоглобина лошади отличается от соответствующего белка человека в 26 местах, свиньи — в 10 местах, а гориллы — всего лишь одной аминокислотой.
Функции белков в организме очень разнообразны. Основные из них учитель может продемонстрировать в виде схемы, заранее нарисованной на доске или выполненной в виде плаката (схема 4).
Схема 4. Функции белков в организме
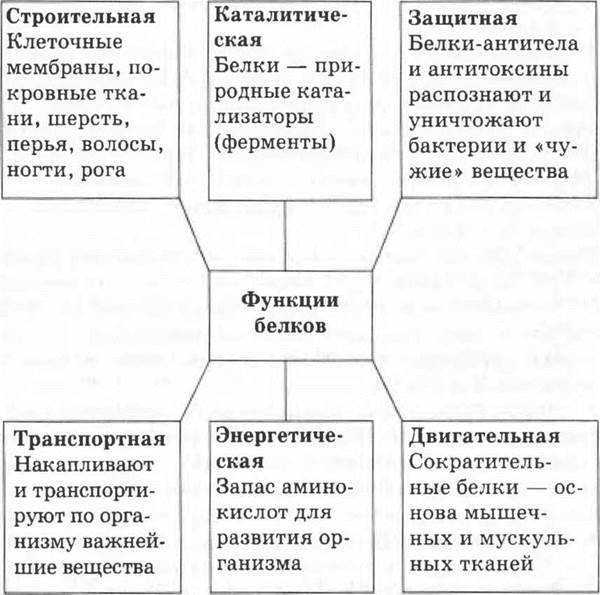
Из приведенной схемы видно, что белки выполняют многочисленные специальные функции. Есть белки — переносчики веществ (молекул, ионов) и электронов; есть биокатализаторы, ускоряющие реакции в миллиарды раз и отличающиеся удивительной специфичностью; есть регуляторы различных биологических процессов в организме — гормоны (например, инсулин, вазопрессин, окситоцин). Важную роль играют структурные и сократительные белки. Белки защищают организм от инфекции, они способны распознавать и уничтожать чужеродные объекты; вирусы, бактерии, клетки. Контакты клетки с внешней средой также выполняют разнообразные белки, умеющие различать форму молекул, регистрировать изменение температуры, ничтожные примеси веществ, отличать один цвет от другого.
V. Белки и пища
Учитель ставит перед учащимися проблемный вопрос: откуда в живой клетке берутся аминокислоты, необходимые для синтеза белка?
В небольшом количестве организм может сам синтезировать аминокислоты, но далеко не все. Восемь аминокислот, необходимых человеку, могут поступать только с пищей. Они называются незаменимыми. Неважно, что человек потребляет «чужие» белки. В пищеварительном тракте под действием ферментов они расщепляется на отдельные аминокислоты, из которых организм сам конструирует новую, необходимую ему, белковую молекулу.
Таким образом, белки — важнейший компонент продуктов питания, необходимый для восполнения энергетических затрат, построения и возобновления тканей организма. Недостаток белка в пище вызывает тяжелые заболевания. Результат несбалансированного питания — плохое самочувствие, истощение и нередко смерть.
Совсем не безразлично, какие белки употребляются в пищу. В кукурузе достаточно белка, но в нем почти нет аминокислоты триптофана, необходимой организму. Большое значение имеет белок, содержащийся в зерне. Самые лучшие сорта пшеницы, и новые, которыми гордятся наши селекционеры, и старые, создавшие славу русскому хлебу, отличаются как раз высоким содержанием и уникальным составом белков. Больше всего белка содержится в мясе, рыбе, молочных продуктах, яйцах и некоторых зернобобовых продуктах.
Свойства белков необходимо знать и учитывать при приготовлении пищи. Учитель проводит небольшой кулинарный «ликбез». Если нужно сварить бульон для первого блюда, в какую воду следует положить мясо — в горячую или холодную? При погружении мяса или рыбы в холодную воду в раствор переходит больше белков и экстрактивных веществ, бульон будет концентрированнее. Правда, часть белка при этом сворачивается и в виде серой пены поднимается на поверхность. Ее необходимо удалить, чтобы она не портила внешний вид и вкус бульона. Если необходимо сварить мясо для второго блюда, его опускают в кипяток. При соприкосновении с горячей водой мясо моментально становится серым, зато хлопьев образуется совсем мало. Тот белок, что находился на поверхности, под действием высокой температуры сразу свернулся и закупорил многочисленные поры, пронизывающие мясо. Экстрактивные вещества, в том числе белки, уже не могут перейти в раствор. Они остаются внутри мяса, придавая ему вкус и аромат. А бульон, разумеется, получается несколько хуже.
Эти же правила нужно соблюдать и при жарке мяса: кусочки, положенные на раскаленную сковороду, теряют меньше мясного сока и получаются более сочными. При жарке теряется меньше питательных веществ, чем при варке. На биологическую ценность белка влияет также продолжительность тепловой обработки. Например, сваренное вкрутую яйцо усваивается организмом труднее, чем сваренное всмятку. Пережаренное мясо жестко, невкусно и плохо усваивается.
В заключение этой части урока можно с помощью биуретовой реакции продемонстрировать, что бульонные кубики («Магги», «Галина Бланка») белка не содержат, они только ароматизаторы и вкусоимитаторы, а не полноценный пищевой продукт.
Стремительный рост населения Земли потребовал поиск новых источников белка. Для борьбы с белковым голоданием химики призвали на помощь... бактерии, которые вырабатывают белок, окисляя углеводороды нефти или природного газа. Промышленное производство белково-витаминного концентрата началось в Советском Союзе с 1963 г. Эти концентраты не предназначены для употребления в пищу людьми, они используются как кормовые добавки в рацион сельскохозяйственных животных. При этом значительно сокращаются сроки откорма, увеличивается среднесуточный привес.
Все больше в наш быт входят продукты питания, изготовленные с добавлением растительного белка (например, соевого) вместо более привычного животного. Растительный белок легко усваивается, кроме того, растительные клетки содержат некоторые ферменты, очень близкие к соответствующим биокатализаторам человеческого организма.
Химия и пища — неисчерпаемая и очень интересная тема. Учитель может «перекинуть мостик» к следующему уроку («Углеводы») таким образом. Человек привык ассоциировать сладкий вкус с сахаром. Но уже в этом небольшом курсе ребята встречались с веществами, сладкими на вкус, но не имеющими с сахарами «родственных связей». Какими? Кто-то вспомнит глицерин, кто-то — аминокислоты (глицин). Учитель акцентирует внимание учащихся: отметьте общий корень этих слов, вспомните его происхождение. Так вот, сахароза — далеко не самое сладкое вещество. Для подслащивания газированных напитков и некоторых других продуктов используется синтетический подсластитель аспартам, который в 300 раз слаще сахара! Он состоит из остатков двух аминокислот, по химическому строению является дипептидом и не противопоказан диабетикам (на этикетках аспартам под различными торговыми названиями обозначается кодом Е951, Е952, Е954). Однако в более дорогие напитки («Фанта», «Миринда», «Спрайт») добавляют все-таки сахар (обратите внимание на этикетку). О нем и родственных ему природных соединениях пойдет речь на следующем уроке.
В зависимости от степени подготовки учащихся в качестве домашнего задания могут быть предложены следующие задачи.
1-й уровень
1. Напишите уравнение реакции аминоуксусной кислоты с гидроксидом натрия.
2. Составьте уравнение реакции образования дипептида из двух молекул аминоуксусной кислоты.
3. Массовая доля аминокислоты в растворе составляет 4%. Какая масса аминокислоты содержится в 170 г этого раствора?
2-й уровень
1. Напишите формулы дипептида, содержащего остатки аланина H2N—CH(CH3)—СООН и глицина NH2—СН2—СООН.
2. Напишите уравнение реакции гидролиза одного из дипептидов из задания 1.
3. Какая масса соли образуется при взаимодействии 120 г раствора глицина с массовой долей 5% и 2 г гидроксида натрия?
3-й уровень
1. Сколько изомерных дипептидов можно составить из остатков аминокислот аланина H2N—CH(CH3)—COOH и глицина NH2—СН2—СООН? Напишите их формулы.
2. Определите молекулярную формулу аминокислоты, содержащей 32,00% углерода, 6,66% водорода, 42,67% кислорода и 18,67% азота. Напишите структурную формулу этой кислоты и назовите ее.
3. Какая масса раствора гидроксида натрия с массовой долей 2% потребуется для взаимодействия с 7,5 г глицина?