Настольная книга учителя по химии 9 класс - поурочные разработки
Металлы в природе. Общие способы их получения - Металлы
Цели урока. Познакомить учащихся с природными соединениями металлов и с самородными металлами. Дать понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро-, гидро- и электрометаллургия.
Оборудование и реактивы. Коллекция руд железа, природных соединений натрия, калия, кальция, магния и алюминия; СuО (порошок и гранулы), Mg (порошок), термит (смесь порошков алюминия и оксида железа — Fe2O3 или Fе3O4), стальные скрепки, Zn (гранулы), НСl (конц. р-р); фарфоровые ступки или неглазурованные фарфоровые пластинки, прибор для получения газов, лабораторный штатив, пробирки, спиртовка.
I. Металлы в природе
На этом этапе урока учитель завершает рассмотрение таблицы «Общие свойства металлов» (двух неразобранных граф ее) и обобщает: металлы в природе могут встречаться в трех формах:
1) только в свободном виде встречаются золото и платина;
2) и в самородном виде, и в форме соединений могут находиться в природе серебро, медь, ртуть и олово;
3) все остальные металлы, которые находятся в ряду напряжений до Sn, встречаются в природе только в виде соединений:
а) хлоридов (сильвин — КСl, галит, или каменная соль, — NaCl, сильвинит — КСl · NaCl);
б) нитратов (чилийская селитра — NaNO3);
в) сульфатов (глауберова соль — Na2SO4 · 10Н2O, гипс — CaSO4 · 2Н2O);
г) карбонатов (мел, мрамор, известняк — СаСO3, магнезит — MgCO3, доломит — СаСO3 · MgCO3);
д) силикатов, в том числе содержащих алюминий — алюмосиликатов (белая глина, или каолин, полевые шпаты, слюда);
е) сульфидов (FeS2 — серный колчедан, HgS — киноварь, ZnS — цинковая обманка);
ж) фосфатов (Са3(РO4)2, который образует основную массу фосфоритов и входит в состав апатитов).
Учитель обобщает:
Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами.
Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическими (например, медно-молибденовые, свинцово-серебряные и т. д.).
Металлургия — это отрасль промышленности, которая занимается получением металлов из руд. Так же называется и наука о промышленных способах получения металлов из руд.
Наиболее пригодны для получения металлов их оксидные руды, в том числе руды железа. Учитель демонстрирует их и предлагает учащимся проделать небольшую лабораторную работу по исследованию предложенных в качестве раздаточного материала руд железа по предложенной инструкции.
Опыт 1. Внимательно рассмотрите образец выданной под номером руды и определите его цвет и блеск.
Опыт 2. Возьмите неглазурованную фарфоровую пластинку (или фарфоровую ступку) и куском руды нанесите на ее поверхности черту. Какого цвета получилась черта?
Опыт 3. Кусок руды поднесите к компасу. Отклоняется ли стрелка компаса? Если да, то велико ли это отклонение?
Результаты опытов можно оформить в виде таблицы.
|
Название руды, формула рудообразующего оксида железа |
Окраска и блеск |
Цвет черты на фарфоре |
Магнитные свойства |
|
1. Магнитный железняк Fe3O4 |
Темно-серый, металлический блеск |
Черная |
Магнитный |
|
2. Красный железняк Fe2O3 |
Красный |
Красная или красно-бурая |
Слабомагнитный |
|
3. Бурый железняк Fe2O3 · nН2O |
Бурый |
Бурая |
Немагнитный |
Учитель продолжает свою мысль о том, что даже если руда будет не оксидной, а сульфидной или карбонатной, то в результате обжига все равно получают исходное оксидное сырье для металлургического процесса, например:
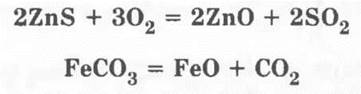
которое затем восстанавливают с помощью различных восстановителей.
II. Общие способы получения металлов
Учитель акцентирует внимание учащихся на том, что это в основном процессы восстановления металлов из их соединений:
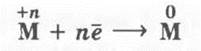
Учитель объясняет эти способы, сопровождая свое объяснение демонстрацией эксперимента.
1. Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью восстановителей (углерода, оксида углерода (II), водорода, металлов — алюминия, магния).
Демонстрация:
1). «Медного зеркала» — получение меди из ее оксида с помощью водорода (см. «Настольную книгу ... 8 класс»);
2). Алюминотермии (там же);
3). Магнийтермии или кальцийтермии (см. предыдущий урок).
2. Гидрометаллургия — это получение металлов, которое проходит в два этапа:
1). Природное соединение «растворяют» в подходящем реагенте с целью получения раствора соли этого металла.
2). Из образовавшегося раствора данный металл вытесняют более активным или восстанавливают электролизом.
Например, чтобы получить медь из руды, содержащей оксид меди (II) СuО, ее обрабатывают разбавленной серной кислотой:
![]()
Затем медь извлекают из раствора соли либо электролизом, либо вытесняют из сульфата железом:
![]()
Таким способом получают серебро, цинк, молибден, золото, уран и др.
Здесь можно использовать лабораторный опыт «Взаимодействие стальных скрепок (Fe) с раствором медного купороса».
3. Электрометаллургия — это способы получения металлов с помощью электрического тока (электролиза). Этим способом получают в основном легкие металлы: алюминий, натрий и др. щелочные металлы, кальций и т. д. — из расплавов их оксидов, гидроксидов или хлоридов. Здесь учитель может рассказать о значении электролиза для получения алюминия.
На Парижской выставке 1855 г. алюминий демонстрировался как самый редкий металл. Он был тогда чуть ли не в десять раз дороже золота. Даже после того, как французский химик Анри Девиль (1818—1881) разработал приемлемый химический способ получения довольно чистого алюминия, стоимость его оставалась довольно высокой. Достаточно сказать, что из алюминия была сделана и торжественно преподнесена сыну Наполеона III погремушка и только очень богатые люди могли позволить себе есть из алюминиевых тарелок. В 1883 г. его выработка во всем мире не достигала и 3 т.
Между тем химикам уже тогда было известно, что алюминий — третий по распространенности на Земле элемент и самый распространенный металл: на его долю приходится более 8% земной коры. Однако в природных соединениях — глиноземах (содержащих оксиды алюминия) он прочно связан с другими элементами, и по сравнению с железом или медью его извлечение из минералов потребует очень больших затрат энергии. В этом производстве без электроэнергии не обойтись.
Сто лет назад американский студент-химик Чарльз Мартин Холл (1863—1914), услышав от своего учителя, с какими трудностями сопряжено восстановление оксида алюминия из глиноземов и как, должно быть, разбогатеет и прославится тот, кто откроет дешевый способ получения алюминия, решил заняться этим. В дровяном сарае он оборудовал лабораторию самодельными и взятыми на прокат аппаратами и довольно скоро открыл, что глинозем можно растворить при 950 °С в расплавленном минерале криолите, а получив раствор оксида, можно путем электролиза выделить и сам алюминий. Удивительно, но в том же 1885 г. французский металлург Поль Эру (1863—1914), которому в то время было столько же лет, сколько и Холлу, разработал тот же метод получения алюминия. Помимо этих совпадений, судьбе было угодно отпустить создателям нового способа восстановления алюминия одинаковое количество лет жизни.
Метод Холла—Эру сделал возможным промышленное получение алюминия. Этот металл теперь известен всем. Он широко распространен и стоит сравнительно дешево. Трудом многих ученых, среди которых видное место занимает Павел Павлович Федотьев (1864—1934), разработавший теорию электролитического способа получения алюминия, была создана мощная индустрия.
Электролитическим способом из расплавов получают 70% магния, большое количество калия, лития, кальция, бария, стронция, бериллия, марганца, а также тугоплавкие металлы: титан, вольфрам, молибден, ванадий, цирконий, тантал, ниобий. Эти металлы широко используются в авиации, космонавтике, атомной промышленности, химической индустрии, на транспорте, в электротехнике, медицине.
Из расплавов электролизом получают и лантаноиды (они применяются как присадки к сталям и чугунам, входят в состав лаков, красок, люминофоров, катализаторов) и актиноиды (многие актиноиды являются топливом в ядерных реакторах).
Электролиз растворов хлорида меди (II) и хлорида цинка можно провести в лаборатории. Для этого используют U-образную трубку или готовят прибор из стеклянной изогнутой трубки (рис. 12). В качестве электродов используют грифели от простых карандашей, а при электролизе хлорида цинка для катода берут медную проволоку. В трубку наливают пипеткой раствор хлорида меди (II) или хлорида цинка, к грифелям плотно прикручивают тонкие медные контакты, которые присоединяют к сухой батарее карманного фонарика. Через некоторое время на аноде ощущается запах хлора, а на катоде выделяется металл.
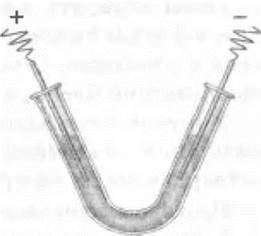
Рис. 12. Упрощенный прибор для электролиза