Химия - учебно-практический справочник
ОРГАНИЧЕСКАЯ ХИМИЯ - Ответы
3.1. Теоретические основы органической химии
Практика
1. С, Н, О, Р, N, S. 2. 1. sр3-Гибридизация: смешивание одной 2s- и трех 2р-орбиталей. Четыре гибридные sp3 — орбитали направлены к вершинам тетраэдра, угол между орбиталями 109° 28'. 2. sр2-Гибридизация: смешиваются одна 2s- и две 2р-орбитали. Три гибридные 5р2-орбитали направлены к вершинам равностороннего треугольника, угол между орбиталями 120°. 3. sp-Гибридизация: смешиваются одна 2s- и одна 2р-орбитали. Две гибридные sp-орбитали образуют друг с другом угол 180°. 3. а) σ-связи атом углерода образует в любом из состояний гибридизации — sp3, sp2 или sp. б) π-связи атом углерода образует за счет р-орбиталей, которые не участвуют в гибридизации, π-связи образуют атомы углерода в состояниях гибридизациsp2 и sp. 4. С2Н4: 5 σ-связей, 1 π-связь; С2Н2: 3 σ-связей, 2 π-связей. 5. Радикалы: СН3—; С2Н5—; —ОН. 6. а) Н2O, HF, С3Н8; СН4; б) NaF; KI. 7. C3H8, С30Н22, С4Н10. 8. 1) три углеводорода содержат первичные атомы углерода:
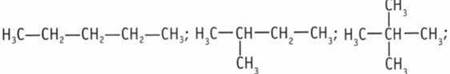
2) два содержат вторичные: 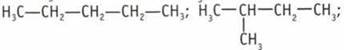
3) один содержит третичный: 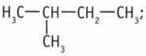 4) один содержит четвертичный:
4) один содержит четвертичный: 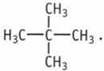 9. 4 изомера. 10.
9. 4 изомера. 10. ![]() реакция соединения. 11.
реакция соединения. 11. 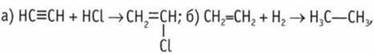 реакция гидрирования (реакция соединения);
реакция гидрирования (реакция соединения); ![]() 12. 3-метил, 4-этилгептен-2.
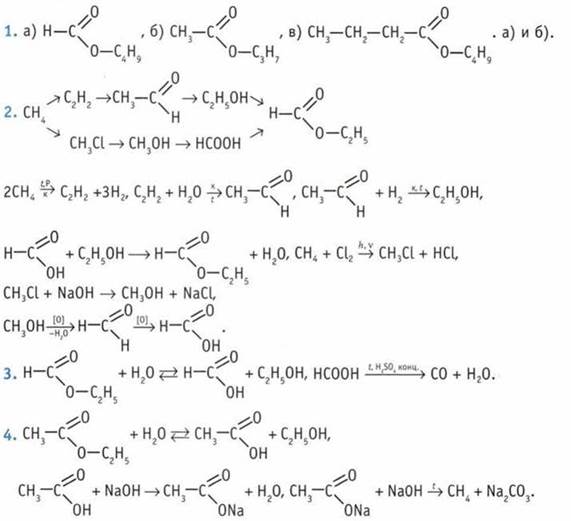
12. 3-метил, 4-этилгептен-2. 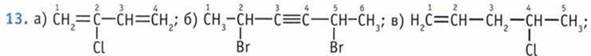
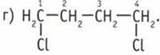 14. Ковалентная связь. Она образуется в результате объединения неспаренных электронов различных атомов в общие электронные пары. 15. Энергия, длина, направленность, кратность, полярность, способ перекрытия орбиталей атомов, в которых содержатся неспаренные электроны.
14. Ковалентная связь. Она образуется в результате объединения неспаренных электронов различных атомов в общие электронные пары. 15. Энергия, длина, направленность, кратность, полярность, способ перекрытия орбиталей атомов, в которых содержатся неспаренные электроны.
Тест
1. Б, В, Г. 2. Б. 3. А, Д, Е. 4. А, В, Г. 5. В. 6. В. 7. Б. 8. Б. 9. Г. 10. А. 11. 1А; 2Б, В. 12. В. 13. Б. 14. Б. 15. А.
3.2. Углеводороды
3.2.1. Алканы (насыщенные углеводороды). Циклоалканы
Практика
1. С повышением молекулярной массы повышается температура кипения и плавления, растет плотность. Вещества с разветвленным строением имеют более высокие tкип., чем с неразветвленным (на примере бутана и его изомера). ![]()
![]() 3. Атомы углерода в алканах пребывают в состоянии sр3-гибридизации. Угол между связями С—С составляет 109°28', а углеродная цепь н-гексана имеет зигзагообразную форму. Форма молекулы 2,2-диметилбутана приближается к сферической. Следовательно, при взаимодействии молекулы 2,2-диметилбутана с другими молекулами площадь контакта и энергия взаимодействия меньше, чем у н-гексана. 4.
3. Атомы углерода в алканах пребывают в состоянии sр3-гибридизации. Угол между связями С—С составляет 109°28', а углеродная цепь н-гексана имеет зигзагообразную форму. Форма молекулы 2,2-диметилбутана приближается к сферической. Следовательно, при взаимодействии молекулы 2,2-диметилбутана с другими молекулами площадь контакта и энергия взаимодействия меньше, чем у н-гексана. 4. 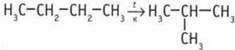 (изобутан (А));
(изобутан (А)); 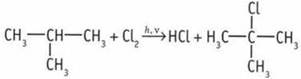 (2-хлор, 2-метилпропан (Б));
(2-хлор, 2-метилпропан (Б)); 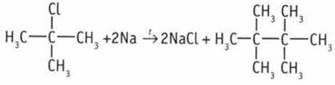 (2,2,3,3-тетраметилбутан (В));
(2,2,3,3-тетраметилбутан (В)); 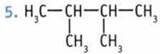 2,3-диметилбутан. 6. 2-метилбутан.
2,3-диметилбутан. 6. 2-метилбутан.
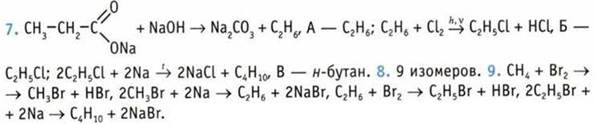
10. б), в), д). 11.5 углеводородов: по одному в С5Н12 и С6Н14 и три в С7Н16. 12. 5 изомеров. 13. 6 изомеров. 14. 80%.
Тест
1. Г. 2. В. 3. Г. 4. В. 5. Б. 6. В. 7. В. 8. Б. 9. 1-Г; 2-В; 3-А; 4-Б. 10. Б. И. В. 12. А. 13. Б. 14. А. 15. В.
3.2.2. Алкены, алкадиены
3.2.3. Алкины
Практика
1. С2Н4 + 3O2 = 2СO2 + 2Н2O; а).
2. а) бутен-1; б) 2-метилпентен-1; в) 2-метилгексен-3; г) 2,3-диметилбутен-2.

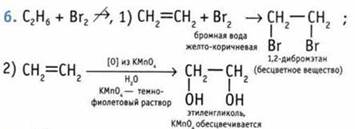
7. а) бутин-1 С≡С sр-гибридизация,угол 180°, С—С sр3-гибридизация, угол 109° 28'; б) 3-метилбутин-1; в) 2,5-диметилгексин-3; г) 2-метилгексин-3.
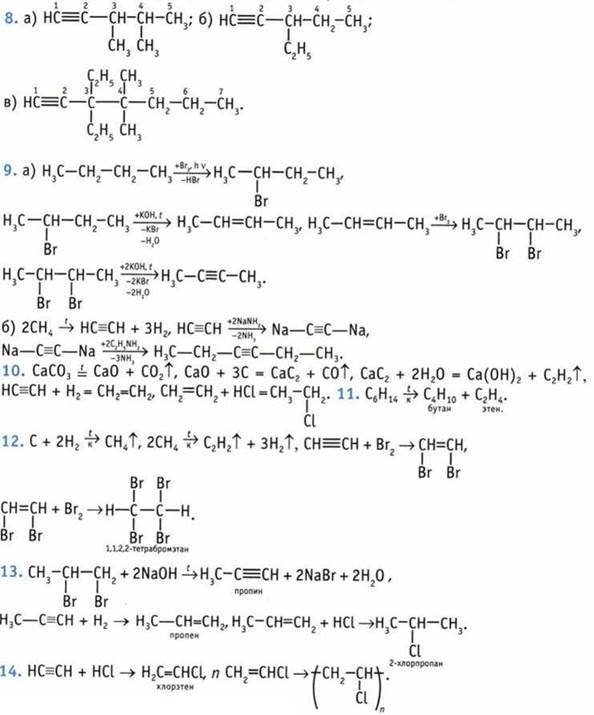
Тест
1. Г. 2. А, В. 3. А, бутен-2. 4. Если хотя бы один атом углерода при двойной связи соединен с одинаковыми атомами или группами атомов, цис-транс-изомерия невозможна. Цис- и транс-изомеры существуют у алкенов «Б» и «Г».
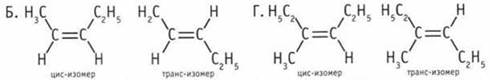
5. А. 6. Б. 7. Б, В, Г. 8. А. 9. Б. 10. А. 11. А. 12. А. 13. В. 14. А. 15. А.
3.2.4. Ароматические углеводороды. Бензол
3.2.5. Природные источники углеводородов (ПИУ) и их переработка
Практика
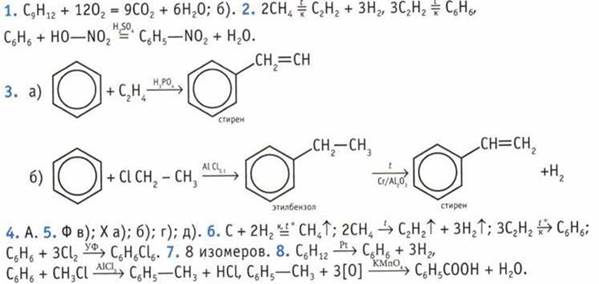
9. X — ацетилен. 10. 56 л. 11. 4 изомера.
Тест
1. Б. 2. Б. 3. В. 4. А. 5. А. 6. Б. 7. Б. 8. 1-Б; 2-В; 3-А; 4-Г. 9. Б. 10. Г. 11. 81,3%. 12. 1-Г; 2-В; 3-Б; 4-А. 13. Б. 14. В. 15. В.
3.3. Кислородсодержащие органические соединения
3.3.1. Спирты
3.3.2. Фенол
Практика
1. а) 3-метилбутанол-2; б) пропандиол-1,3; в) 2-метилпропанол-2; г) бутанол-2; д) бутандиол-2,3; е) пентанол-3; ж) 2-метилпропанол-1. 2. Структурная изомерия. Разветвление углеродного скелета: ![]() — 2-метилпропанол-1. Положение функциональной группы (—ОН):
— 2-метилпропанол-1. Положение функциональной группы (—ОН): ![]() — бутанол-2.
— бутанол-2.
Межклассовая изомерия: С2Н5—О—С2Н5 — диэтиловый эфир, СН3—О—С3Н7 — метилпропиловый эфир (это изомеры бутанола).
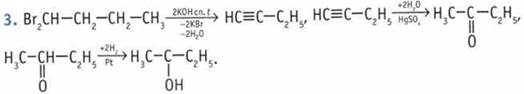
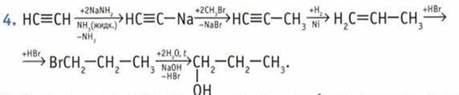
5. Определить, какой спирт находится в пробирке, позволяет проба Лукаса. В пробирку добавляют раствор ZnCl2 в концентрированной соляной кислоте. В результате реакции образуется нерастворимый алкилхлорид. В случае третичного спирта наблюдается мгновенное помутнение, вторичного — в течение нескольких минут, тогда как первичный спирт образует алкилхлорид только при нагревании.
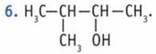
7. Сродство вещества с водой зависит от его способности образовывать связи с молекулами воды. Группа —ОН образует водородную связь с молекулой воды, а малополярные углеводородные радикалы таких связей не образуют. Поэтому чем больше радикал, тем растворимость в воде меньше, а чем больше полярных групп (—ОН) в молекуле, тем она больше. Сродство с водой возрастает в ряду: бутан, бутанол, метанол. 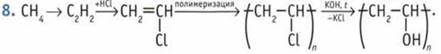
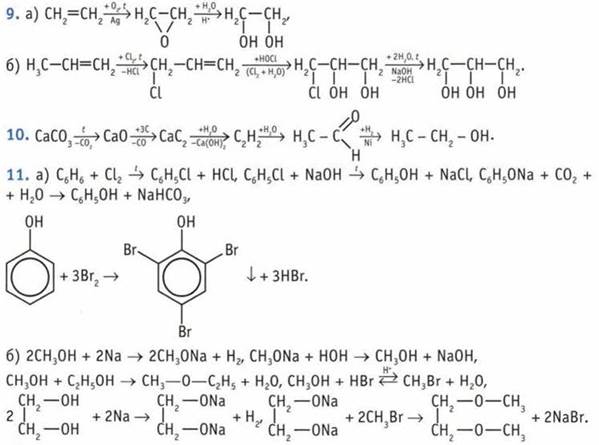
12. Три спирта.
Тест
1. В. 2. 1-В, 2-Г, 3-Б, 4-А. 3. А хлорэтан. 4. 1-Б; 2-А; 3-Г; 4-В. 5. Г. 6. Б. 7. 1-А; 2-Г; 3-Б; 4-В. 8. Б. 9. Б. 10. В. 11. Б. 12. Б. 13. В 14. В. 15. Б
3.3.3. Альдегиды
Практика
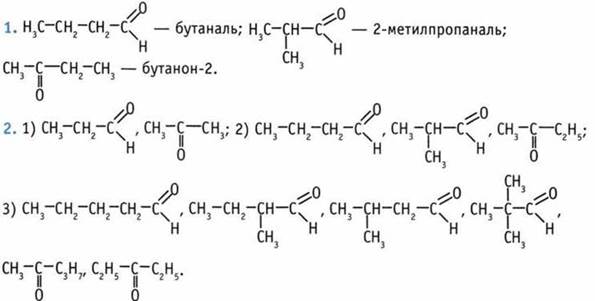
Такую же молекулярную формулу имеют ненасыщенные одноатомные спирты. 3. Гептаналь. 4. А — бутаналь; Б — пентаналь; В бутанон-3. 5. Гомологи 1) а и д; 2) б, в, г.
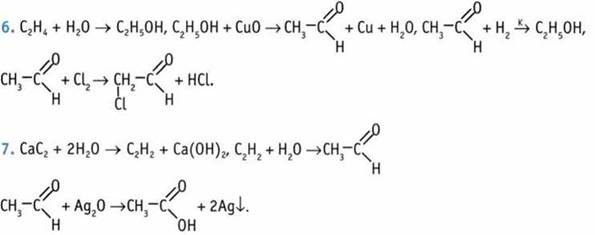
8. Добавляем FeCl3: там, где фенол — фиолетовая окраска. А потом добавляем Сu(ОН)2.
При нагревании с альдегидом: 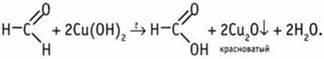
Глицерин + Сu(ОН)2 → образование синего раствора.
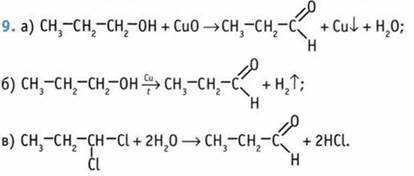
11. 1-Б, 2-А, 3-В, 4-Г, 5-В. 12. 21,2 моль. 13. Бутаналь. 14. 49,5 г. 15. 70%.
Тест
1. В. 2. Б. 3. А. 4. В. 5. Б. 6. Г. 7. Б. 8. Б. 9. Б. 10. В. 11. Б. 12. А. 13. А. 14. А. 15. А.
3.3.4. Карбоновые кислоты
Практика
1. а) 3-метилбутановая кислота; б) 2-хлорпропановая кислота; в) 2-метилпропановая кислота; г) 2,2,2-трихлорэтановая кислота; д) 2,3-диметилбутановая кислота.
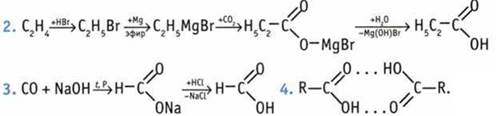
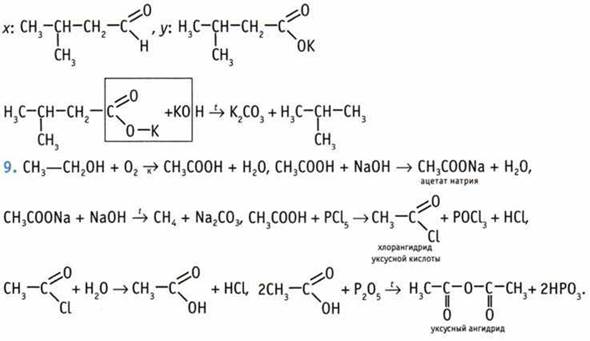
5. а) Реакцию «серебряного зеркала» дает только НСООН; б) бромную воду обесцвечивает только Н2С=СН—СООН. 6. а) Н3ССООН < НСООН < НООС—СООН; б) СlН2ССOOН < Сl2НССOOН < Cl3CCOOH. ![]() 8. Из условия задачи следует, что х— одноосновная карбоновая кислота. При прокаливании калиевых солей карбоновых кислот с КОН происходит укорачивание углеродной цепи на один атом. В связи с этим:
8. Из условия задачи следует, что х— одноосновная карбоновая кислота. При прокаливании калиевых солей карбоновых кислот с КОН происходит укорачивание углеродной цепи на один атом. В связи с этим:
Тест
1. В. 2. Б. 3. Г. 4. В. 5. 1-В, 2-Г, 3-А, 4-Б. 6. В. 7. Г. 8. Б. 9. Б. 10. В. 11. Б. 12. 1-Г; 2-В; 3-А; 4-Б. 13. А. 14. В. 15. Г.
3.3.5. Сложные эфиры. Жиры
Практика
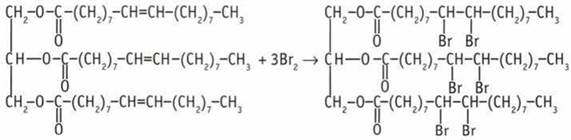
5. А — жидкий жир (триолеин), Б — твердый жир (тристеарин). 6. Взаимодействие с бромной водой. У ненасыщенных жиров происходит обесцвечивание реагента (Вr2).
7. Находясь в контакте с влажным воздухом, жиры гидролизуют и окисляются. Продуктами этих преобразований являются альдегиды, кетоны, другие соединения с меньшим количеством атомов углерода в молекулах. Они в основном имеют неприятный запах и горький вкус. ![]() Щелочь, которая образуется во время гидролиза мыла, разъедает ткани, разрушает красители. Мыло утрачивает свои свойства в жесткой воде, так как ионы кальция и магния, которые в ней содержатся, образуют с анионами жирных кислот малорастворимые соли:
Щелочь, которая образуется во время гидролиза мыла, разъедает ткани, разрушает красители. Мыло утрачивает свои свойства в жесткой воде, так как ионы кальция и магния, которые в ней содержатся, образуют с анионами жирных кислот малорастворимые соли: ![]() где M2+ — ионы Са или Мg, RСOO- — анионы жирных кислот. 9. m(р-ра) = 2,7 т. 10. 1,98 г. 11. 83,3%. 12. НСООН — 24, 5%, СН3СН2СООН — 75,5 %. 13. 4,42 кг. 14. Тристеарат. 15. Добавьте бромную воду, она обесцвечивается.
где M2+ — ионы Са или Мg, RСOO- — анионы жирных кислот. 9. m(р-ра) = 2,7 т. 10. 1,98 г. 11. 83,3%. 12. НСООН — 24, 5%, СН3СН2СООН — 75,5 %. 13. 4,42 кг. 14. Тристеарат. 15. Добавьте бромную воду, она обесцвечивается.
Тест
1. Б. 2. Г. 3. А. 4. Б. 5. В. 6. Г. 7. В. 8. Б. 9. Б. 10. Б.
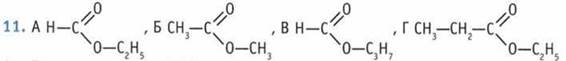
А и Б - изомеры. 12. Б. 13. Б. 14. Б. 15. 1-Г; 2-В; 3-Б; 4-А.
3.3.6. Углеводы
Практика
1. Спиртовым раствором иода, синего цвета.
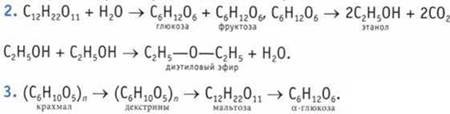
4. Глюкоза — виноградный сахар, фруктоза — фруктовый сахар. ![]()
![]()
По уравнению 1: v(CO2) = 2v(C6H12O6) = 2 ∙ 36 г : 180 г/моль = 0,4 моль, v(Ca(OH)2 = 22,2 г : 74 г/моль = 0,3 моль.
По уравнению 2 при взаимодействии 0,4 моль СO2 и 0,3 моль Са(OН)2 образуется 0,2 моль Са(НСO3)2 и остается в избытке 0,3 - 0,2 = 0,1 моль Са(OН)2. Этот избыток Са(OН)2 реагирует с Са(НСO3)2 → уравнение 3. Весь Са(OН)2 используется, связывается 0. 1 моль Са(НС03)2 и образуется 2 ∙ 0,1 = 0,2 моль СаСO3. Таким образом, образовалось (0,2 - 0,1) = 0,1 моль Са(НСO3)2и 0,2 моль СаСO3. 6. 67,2 л. 7. 675 г. 8. 160 л. 9. 270 кг. 10. 0,06 г. 11. 36 г.
Тест
1. Б, Д. 2. Б, Г, Д. 3. Б, В. 4. В. 5. А, В, Г. 6. Б. 7. В. 8. Б. 9. Б. 10. В. 11. В. 12.1-Б; 2-А; 3-Г; 4-В. 13. Б. 14. 1-В; 2-Г; 3-А; 4-Б. 15. В.
3.4. Азотсодержащие органические соединения
3.4.1. Амины
Практика
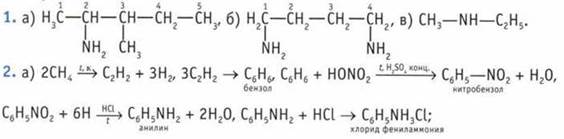
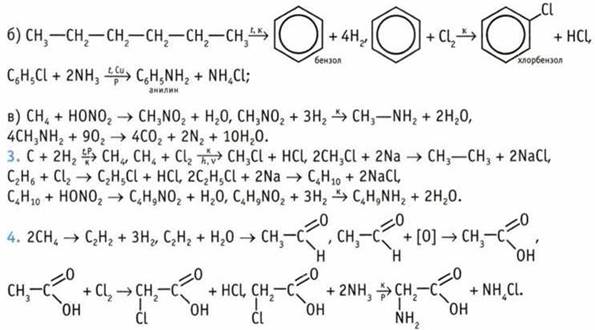
5. Анилин легко реагирует с бромной водой. Происходит реакция замещения с образованием белого осадка.
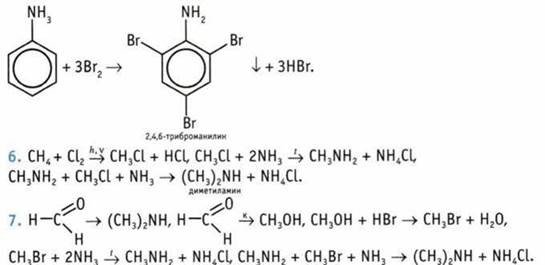
8. 8 изомерных аминов. 9. X — анилин. 10. 312 кг. 11. 66 г. 12. 1,344 л.13. 55,2 мл. 14. Пропиламин. 15. CH5N.
Тест
1. Б. 2. А. 3. Б. 4. В. 5. Б. 6. 1-В; 2-А; 3-Б. 7. 1-Б; 2-А; 3-В. 8. В. 9. 1-Б; 2-А; 3-Г; 4-В. 10. Б. 11. А. 12. Б. 13. А. 14. Б. 15. Г.
3.4.2. Аминокислоты
3.4.3. Белки
Практика
1. а) 2,4-диамино, 4-метилпентановая кислота; б) 4-аминопентановая кислота; в) 4-амино, 2-метилпентановая кислота; г) 3-амино, 2-этилбутановая кислота.
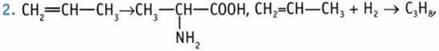
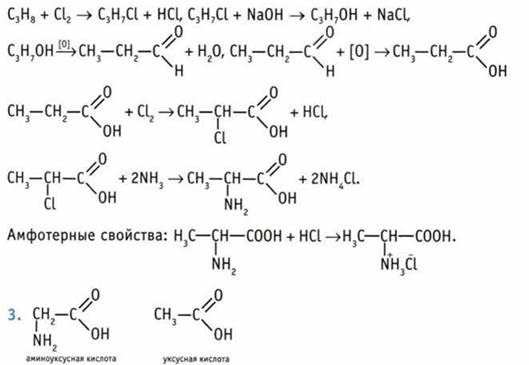
Раствор аминоуксусной кислоты является нейтральным, индикаторы в нем не меняют своей окраски. В уксусной кислоте среда кислая.
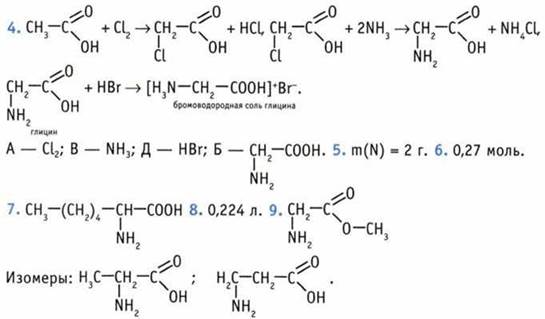
10. 15,8 г. 11. 254. 12. 63,5 мл. 13. 27,6 мл. 14. 30,7 мл. 15. Они содержат группы —NH2 и —СООН.
Тест
1. А, нейтральная; Б, нейтральная; В, кислая. 2. В. 3. Б. 4. В. 5. В. 6. В, Г. 7. А. 8. В. 9. В. 10. В. 11. Г. 12. В. 13. А. 14. В. 15. В. 16. В.
3.5. Синтетические высокомолекулярные вещества и полимерные материалы на их основе
Практика
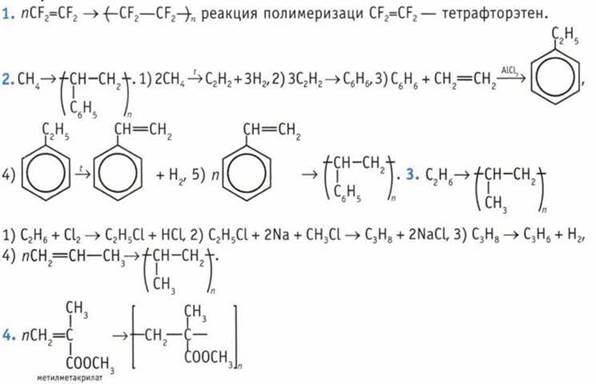
5. Фенолформальдегидные смолы. Их добывают поликонденсацией фенола С6Н5OН с формальдегидом НСНО. Формула полимера:
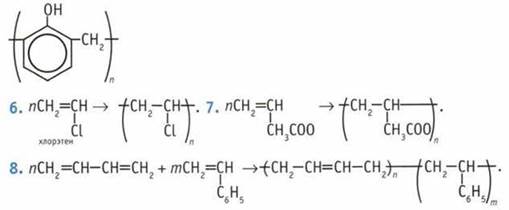
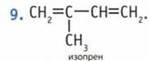 10. Реакции полимеризации и совместной полимеризации.
10. Реакции полимеризации и совместной полимеризации. 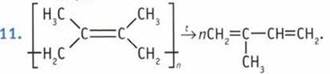 12. Кислородом воздуха, соединениями железа(III), перманганатом калия КМnO4. 13. Каучуки. 14. Целлюлоза. 15. Из природных полимеров, целлюлозы.
12. Кислородом воздуха, соединениями железа(III), перманганатом калия КМnO4. 13. Каучуки. 14. Целлюлоза. 15. Из природных полимеров, целлюлозы.
Тест
1. Б. 2. Г. 3. Г. 4. Г. 5. В. 6. Б. 7. Б. 8. А, Б, Д. 9. В, Г. 10. А, В. 11. А, Г. 12. В. 13. А. 14. А, Г. 15. Б.
3.6. Обобщение знаний об органических соединениях
Практика
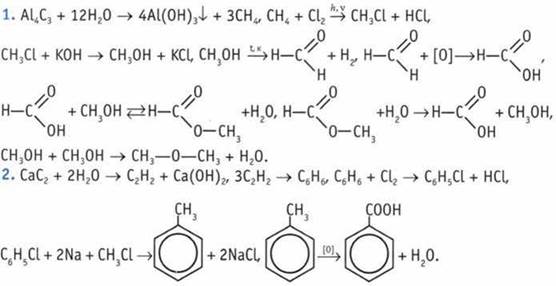
3. Реакция «серебряного зеркала» свидетельствует о наличии группы 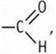 получение метанола при восстановлении — об отсутствии связи С—С в молекуле С2Н4O2. Указаннымусловиям отвечает структурная формула
получение метанола при восстановлении — об отсутствии связи С—С в молекуле С2Н4O2. Указаннымусловиям отвечает структурная формула 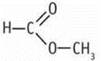

Тест
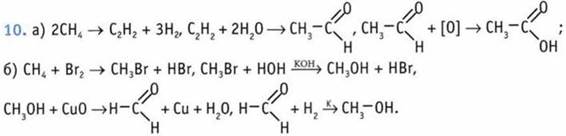
1 В. 2. В. 3. А, В. 4. Б. 5. 1-Г; 2-А; 3-Б; 4-В. 6. Б. 7. А; В; Г. 8. Б. 9. А и Б. 10. X — ацетилен. ![]()
![]()