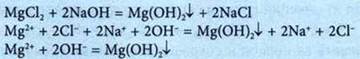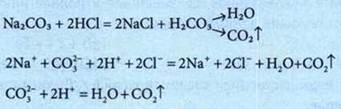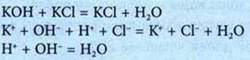Химия - учебно-практический справочник
Смеси веществ. Растворы - Общая химия
Смеси веществ бывают однородные (растворы) и неоднородные (суспензия, эмульсия, пена, аэрозоль).
|
Раствор – однородная смесь веществ |
по агрегатному состоянию |
твердые (тв. + тв.) |
|
жидкие (ж. + ж., г. + тв., ж. + тв.) (вода + уксус, облака, вода + сахар) |
||
|
газообразные (г. + г.) (воздух) |
||
|
по степени достижения |
насыщенный |
|
|
предела растворимости |
ненасыщенный |
|
|
по отношению к электрическому току |
электролиты |
|
|
неэлектролиты |
||
|
компоненты |
растворитель |
|
|
растворенное вещество |
||
|
по консистенции |
концентрированный (60 г сахара в 100 г Н2O) |
|
|
разбавленный (60 г сахара в 100 кг Н2O) |
Смеси, в которых частицы твердого вещества распределены в жидкости, называются суспензиями (глина с водой, мел с водой).
Системы, в которых частицы одной жидкости распределены в другой жидкости, называются эмульсиями (молоко, хорошо взболтанные масло с водой).
Неоднородную смесь жидкости и газа называют пеной (мыльная пена, пенопласт).
Свойство вещества образовывать с другим веществом раствор называют растворимостью.
Факторы, по которым определяют растворимость
|
Факторы |
Примеры |
|
• природа компонентов раствора: — полярные и ионные соединения хорошо растворяются в полярных растворителях; — неполярные — в неполярных |
В воде (полярное соединение) растворяется поваренная соль NaCl (ионное соединение), плохо растворяются соединения с неполярной или слабополярной связью (Н2, жир, бензин) |
|
• температура: — растворимость твердых веществ в воде, как правило, с повышением t° увеличивается; — растворимость жидкостей в жидкостях с повышением t° увеличивается. Иногда они расслаиваются; — растворимость газов в жидкостях с повышением t° уменьшается |
В NaCl при повышении t° растворимость увеличивается незначительно, а в Са(ОН)2— даже снижается. В теплой воде растворимость сахара увеличивается. В теплой воде растворимость воздуха уменьшается |
|
• давление: — давление влияет только на растворимость газов. Растворимость газа при постоянной t° прямо пропорциональна его парциальному давлению (закон Генри) |
СО2, который был растворен в напитке под давлением, при увеличении t° начинает из него быстро выделяться, если бутылку с напитком открыть |
Растворимость (S) — максимальная масса вещества, которая растворяется при определенной температуре в 100 г растворителя с образованием насыщенного раствора:
![]()
Массовая доля вещества в смеси:
![]()
Массовую долю выражают в долях единицы или в процентах (0,5 или 50%).
Объемная доля газа в смеси:
![]()
V(смеси) = V1 + V2 + ... только при постоянных t° и р.
|
Методы разделения смесей |
|
|
однородных |
неоднородных |
|
• испарение (разница tкип. компонентов смеси значительная) • перегонка (разница tкип. компонентов смеси незначительная) |
• фильтрование (один или несколько компонентов смеси нерастворимы в воде) • отстаивание (компоненты смеси нерастворимы один в другом и имеют разную плотность) • центрифугирование (компоненты смеси имеют разную плотность) |
Кристаллогидраты — кристаллические вещества, содержащие молекулы воды.
CuSO4 ∙ 5Н2O — сульфат меди (II), пентагидрат; медный купорос;
CaSO4 ∙ 2Н2O — гипс.
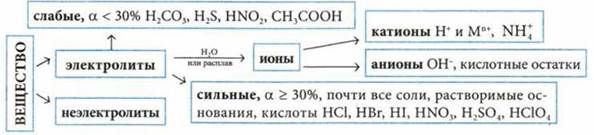
Электролитическая диссоциация — распад вещества на ионы во время его растворения или плавления.
Основные положения теории электролитической диссоциации С. Аррениуса (1883)
α — степень электролитической диссоциации
![]()
N — количество молекул, которые распались на ионы;
N0 — общее количество молекул в растворе.
Диссоциация электролитов
|
Диссоциация сильных электролитов — кислот |
|
|
— растворимых оснований (щелочей) |
|
|
— солей |
|
|
Диссоциация слабых электролитов осуществляется ступенчато |
|
Н2O — слабый электролит.
![]()
Связь, образующаяся между атомом водорода одной молекулы и атомом сильно электроотрицательного элемента (О, S, N, F и т. д.) другой молекулы, называется водородной. Ее обозначают точками, она слабее чем ионная или ковалентная связь, но сильнее обычного межмолекулярного взаимодействия.
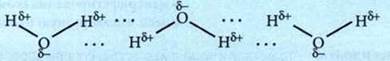
Окраска индикаторов
|
Индикатор |
|
Среда |
|
|
кислая |
щелочная |
нейтральная |
|
|
универсальный |
розовый |
синий |
желтый |
|
лакмус |
розовый |
синий |
фиолетовый |
|
фенолфталеин |
бесцветный |
малиновый |
бесцветный |
|
метилоранж |
розовый |
малиновый |
оранжевый |
Ионно-молекулярное уравнение — это уравнение, которое содержит формулы веществ и формулы ионов.
Реакции обмена между электролитами в растворе — это реакции между ионами в растворах электролитов.
Условия, при которых реакции обмена между электролитами в растворе происходят до конца
|
Условие |
Молекулярное и ионно-молекулярное уравнения |
|
1. Образование осадка |
|
|
2. Образование газа |
|
|
3. Образование слабого электролита или Н2O |
|
Аррениус Сванте Август (1859-1927) — шведский физико-химик. Автор теории электролитической диссоциации. Профессор университета в Стокгольме и директор Нобелевского института. Ему принадлежит ряд исследований в астрономии, космической физики и в области применения физико-химических законов при изучении биологических процессов.
ПРОВЕРЬТЕ СЕБЯ
1. Составьте молекулярные уравнения, соответствующие ионно-молекулярным уравнениям.

2. Какая из реакций добычи сернистого газа является реакцией ионного обмена?
![]()
Напишите ее полное и сокращенное ионные уравнения.
3. Напишите молекулярное, сокращенное и полное ионное уравнения реакций, соответствующие данным схемам.
![]()
4. В 144 г воды растворили кислоту массой б г. Вычислите массовую долю кислоты в растворе.
5. Найдите массовую долю воды в медном купоросе.
6. Какую массу нитрата натрия необходимо растворить в 400 г воды для получения раствора с массовой долей вещества 20%?
7. К 200 г раствора, массовая доля вещества в котором 0,3, добавили 100 г воды. Вычислите массовую долю растворенного вещества в полученном растворе.
8. В 500 г раствора, насыщенного при 20 °С, содержится 120 г нитрата калия. Определите растворимость этой соли.
9. Подберите по две пары электролитов, которые реагируют 8 растворе с образованием
а) гидроксида алюминия; б) кремниевой кислоты.
10. Определите массы хлорида бария с массовой долей 10% и 50%, необходимые для приготовления 800 г раствора с массовой долей 20%.
11. Дополните высказывание.
Раствор, в котором данное вещество при определенной температуре больше не растворяется, называют...
12. Как превратить насыщенный раствор в ненасыщенный? Ответ обоснуйте, исходя из определения растворимости вещества.
13. В воде массой 400 г растворили сероводород объемом 12 мл (н. у.). Определите массовую долю сероводорода в растворе.
14. В воде массой 40 г растворили железный купорос FeSO4 ∙ 7Н2O массой 3,5 г. Определите массовую долю сульфата железа(II) в полученном растворе.
15. Какую массу ортофосфата калия и воды нужно взять для приготовления 250 г раствора с массовой долей К3РO4 8%?
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите соединения, с которыми взаимодействует в водном растворе сульфат железа(II).
А соляная кислота
Б гидроксид калия
В сульфид натрия
Г нитрат бария
Д угольная кислота
![]()
2. Какие ионы не могут одновременно находиться в водном растворе?

![]()
3. Растворение - это процесс
А биологический
Б физический
В химический
Г физико-химический
4. Растворами являются
А почва
Б воздух
В лимфа
Г пластмассы
![]()
5. Нерастворимыми веществами являются
А стекло
Б масло
В сахар
Г золото
![]()
6. Укажите реакцию обмена с образованием осадка.
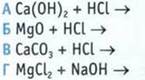
7. Установите соответствие между исходными веществами и продуктом реакции.
Исходные вещества
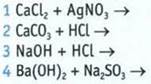
Продукт реакции
А слабый электролит
Б нерастворимое соединение
В газ
Г малорастворимое соединение
Д синий осадок
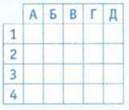
8. Установите соответствие между молекулярным и ионно-молекулярным уравнениями.
Молекулярное уравнени.
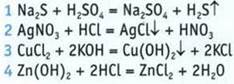
Ионно-молекулярное уравнение

9. Подберите пару различных электролитов, которые реагируют в растворе с образованием гидроксида алюминия.
А Аl2O3 и NaOH
Б АlСl3 и КОН
В Al2(SO4)3 и NaNO3
Г Al(N03)3 и K2SO4
10. Какие ионы не могут одновременно находиться в водном растворе?
A Na+ и К+
Б Na+ и Cl-
В Аl3+ и ОН-
Г Na+ и S2-
11. В каком случае при взаимодействии веществ образуются нерастворимое основание и растворимая соль? Запишите уравнение реакции.
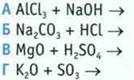
12. Какие соединения в водном растворе не реагируют?
A Ba(NO3)2 и H2S
Б КОН и HNO3
В К2СO3 и Ва(ОН)2
Г Na2S и H2SO4
13. С помощью индикатора можно обнаружить в водном растворе щелочи ионы ОН-. Установите соответствие между индикатором и его цветом в щелочной среде.
Индикатор
1 фенолфталеин
2 метилоранж
3 лакмус
4 универсальный
Цвет в щелочной среде
А сине-зеленый
Б малиновый
В желтый
Г синий
Д фиолетовый
14. Какие электролиты диссоциируют в водных растворах или расплавах на катионы металлических элементов или анионы кислотных остатков?
А кислоты
Б соли
В основания
Г оксиды