Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Окислительно-восстановительные реакции - Теоретический материал - ОСНОВЫ ХИМИИ
Окислительно-восстановительные реакции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ.
В процессе окислительно-восстановительной реакции восстановитель отдает электроны, т.е. окисляется; окислитель присоединяет электроны, т.е. восстанавливается. Причем любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого. К типичным (сильным) окислителям относят: F2, Сl2, O2, КСlO3, H2S04 (КОНЦ.), HNO3, КМNO4, МnO2, К2Сr2O7, РbO2 и др. К типичным (сильным) восстановителям относят: Н2, С (графит), Zn, Al, Са, KI, SO2, H2S, СО и другие.
Окислительно-восстановительные реакции могут быть нескольких видов.
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ. Например:
H2S + Сl2 = S + 2НСl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества. Например:
NH4NO3 = N2O + 2Н2O
Диспропорционирования (самоокисление-самовосстановление) — реакции, в которых атомы одного элемента и окисляются, и восстанавливаются (повышают степень окисления и понижают). Например:
Сl2 + Н2O = НСlO + НСl
Расстановку коэффициентов в уравнених окислительно-восстановительных реакций осуществляют методом электронного баланса или методом полуреакций.
Метод электронного баланса
Составим уравнение реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (лабораторный способ получения хлора):
![]()
Покажем изменение степеней окисления атомов:
![]()
Это окислительно-восстановительная реакция, так как в ходе реакции изменяются степени окисления атомов хлора и марганца. НСl — восстановитель, МnO2 — окислитель.
Составляем электронные уравнения:
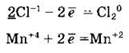
Находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления 1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении, его же мы и переносим в молекулярное уравнение:
![]()
Находим коэффициенты для других реагирующих веществ.
Из электронных уравнений видно, что на 2 моль НСl приходится 1 моль МnO2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид:
![]()
Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например, хлора: в левой части 4 и в правой 2 + 2 = 4.
Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме.
Перепишем составленное уравнение в ионной форме:
![]()
После сокращения одинаковых ионов в обеих частях уравнения получим краткое ионное уравнение
![]()
Метод полуреакций
Как показывает название, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение.
В качестве примера составим уравнение для схемы реакции:
![]()
При пропускании сероводорода H2S через подкисленный раствор перманганата калия КМnO4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы, т.е. протекания процесса:
![]()
Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
![]()
Это первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnO4 (он имеет малиновую окраску) в ион Мn2+ (практически бесцветный и лишь при большой концентрации имеет слаборозовую окраску), что можно выразить схемой:
![]()
В кислом растворе кислород, входящий в состав ионов МnO4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
![]()
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные — два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
![]()
Это вторая полуреакция — процесс восстановления окислителя, т.е. перманганат-иона.
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится так:
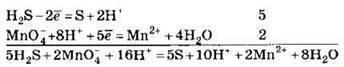
И, сократив на 10Н+ левую и правую часть уравнения, получим:
![]()
Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-) + (6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
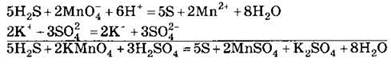
Таким образом, составление уравнений окислительновосстановительных реакций с помощью метода полуреакций приводит к тому же результату, что и метод электронного баланса.
Сопоставим оба метода. Достоинство метода полуреакций по сравнению с методом электронного баланса в том, что в нем применяются не гипотетические ионы, а реально существующие. В самом деле, в растворе присутствуют ионы ![]()
![]()
При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец, при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах.