Химия самостоятельная подготовка к ЕГЭ - универсальные материалы с методическими рекомендациями, решениями и ответами - 2018 год
Характерные химические свойства азотсодержащих органических соединений - Теоретический материал - ОРГАНИЧЕСКАЯ ХИМИЯ
Амины — органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
RNH2, R2NH, R3N
1. Основность аминов
Для аминов характерны ярко выраженные основные свойства (за что их часто называют органическими основаниями).
Водные растворы алифатических аминов проявляют щелочную реакцию среды, так как амины взаимодействуют с водой аналогично аммиаку:
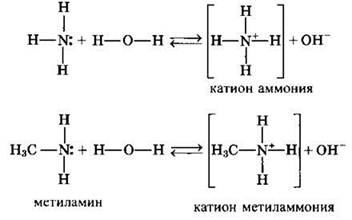
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины — более сильные основания, чем аммиак, так как алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами. Например, анилин
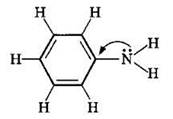
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (НСl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида.
2. Взаимодействие с кислотами с образованием солей
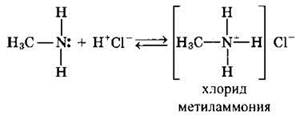
Соли аминов — твердые вещества, хорошо растворимые в воде. Щелочи (более сильные основания) легко вытесняют из них амины:
![]()
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
На основность аминов влияют различные факторы: электронные эффекты углеводородных радикалов, пространственное экранирование радикалами атома азота, а также способность образующихся ионов к стабилизации за счет взаимодействия с растворителем. В результате +I-эффекта алкильных групп основность алифатических аминов в газовой фазе (без растворителя) растет в ряду: первичные < вторичные < третичные.
Однако в растворах основные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (—F, —Сl, —NO2 и т.п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил, —ОСН3, —N(CH3)2и др.), напротив, увеличивают.
Основность простейших аминов (в растворе) возрастает в ряду:
![]()
3. Окисление аминов
Алифатические амины окисляются под действием сильных окислителей. В отличие от аммиака, низшие газообразные амины способны воспламеняться от открытого пламени.
Реакция горения (полного окисления) аминов на примере метиламина:
![]()
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
Первичные алифатические амины с HNO2 образуют спирты. Характерным признаком реакции является выделение азота (дезаминирование аминов):
![]()
Анилин, или фениламинC6H5NH2 — важнейший из ароматических аминов:
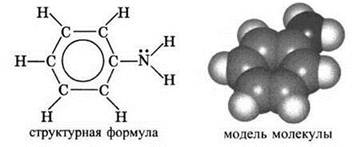
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. -6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением π-электронов бензольного кольца с неподеленной электронной парой атома азота.
1. Взаимодействие с кислотами
![]()
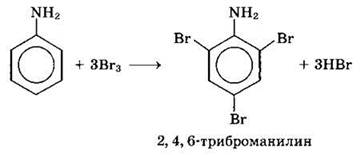
2. Взаимодействие с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
3. Взаимодействие анилина с азотистой кислотой (при температуре около 0 °С). В результате этой реакции {реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
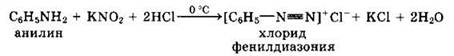
4. При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
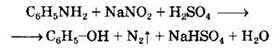
Свойства аминокислот
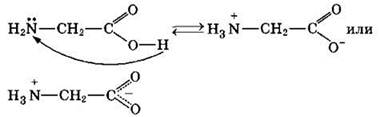
Физические свойства. Аминокислоты — твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
Химические свойства. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот, т.е. являются амфотерными соединениями.
1. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
![]()
2. Как карбоновые кислоты они образуют функциональные производные:
а) соли
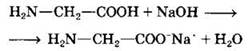
б) сложные эфиры
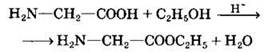
3. Возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
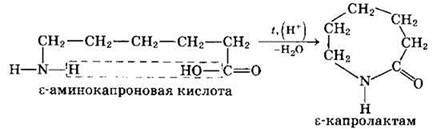
4. Межмолекулярное взаимодействие а-аминокислот приводит к образованию пептидов. При взаимодействии двух а-аминокислот образуется дипептид.
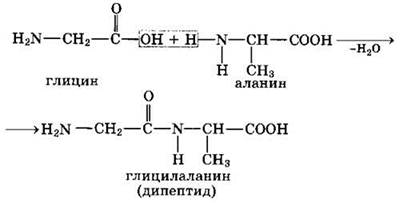
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь СО—NH-пептидной связью.
Важнейшие природные полимеры — белки относятся к полипептидам, т. е. представляют собой продукт поликонденсации а-аминокислот.