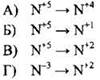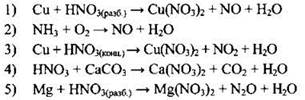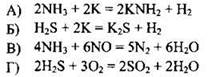Химия - Единый государственный экзамен - Комплекс материалов для подготовки учащихся - 2018 год
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ - ЗАДАНИЯ ДЛЯ ТЕМАТИЧЕСКОГО КОНТРОЛЯ
Задания с комментариями и решениями
Пример 44. Установите соответствие между изменением степени окисления азота и схемой реакции, в которой это изменение происходит.
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ |
СХЕМА РЕАКЦИИ
|
Ответ:
|
A |
Б |
В |
Г |
Для поиска ответа следует определить степень окисления азота во всех соединениях, приведённых в правом столбце:
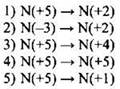
Теперь ответ очевиден:
Ответ:
|
A |
Б |
В |
Г |
|
3 |
5 |
1 |
2 |
Ответ: 3512
Пример 45. Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции.
|
УРАВНЕНИЕ РЕАКЦИИ
|
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
|
Ответ:
|
А |
Б |
В |
Г |
Окислитель - элемент, атомы которого принимают электроны (или вещество, содержащее такой элемент). В первой реакции окислителем является аммиак за счёт водорода(+I):
![]()
Во второй реакции окислителем является сероводород также за счёт водорода(I). В третьей реакции окислителем является оксид азота(II) за счёт N+2:
![]()
В последней реакции окислителем является молекулярный кислород:
![]()
Теперь ответ очевиден:
|
А |
Б |
В |
Г |
|
4 |
4 |
3 |
6 |
Ответ: 4436
Пример 46. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
Выполнение задания следует начать с определения того, какие элементы изменяют степень окисления. В данном примере изменяет степень окисления элемент марганец:
![]()
Атомы марганца, входящие в состав КМnO4 понижают свою степень окисления до +4, т.е. принимают по три электрона, а атомы марганца в степени окисления +2 повышают ее до +4, следовательно, отдают по 2 электрона. Процесс отдачи электронов называется окислением, а элемент, отдающий электроны, является восстановителем. Значит MnSO4 за счет марганца в степени окисления +2 является восстановителем.
Процесс принятия электронов называется восстановлением, а элемент, который принимает электроны, является окислителем. Значит, КМnO4 за счет марганца в степени окисления +7 является окислителем.
Далее необходимо составить уравнение реакции, а для этого нужно прежде всего определить, какие продукты образуются в результате реакции. Здесь важно обратить внимание нахреду, в которой происходит взаимодействие указанных веществ. В зависимости от среды восстановление и окисление ионов происходит по-разному. Например, ион МnO4 в кислотной среде превращается в ион Мn2+, в щелочной - в ион МnО42-, а в нейтральной среде - в оксид марганца(IV) МnO2.
Приходим к выводу, что в левой части уравнения пропущенным веществом является вода, а в правой - серная кислота.
![]()
Коэффициенты, полученные при составлении электронного баланса, поставим в левую часть схемы реакции:
![]()
Суммируем число атомов марганца и ставим полученную сумму (5) перед оксидом марганца(IV). Число атомов калия в левой и правой части равны 2. Остается определить оставшиеся коэффициенты перед водой и серной кислотой. Получаем уравнение реакции:
![]()
Пример 47. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
Задание выполняется по тому же плану, как и предыдущее:
1) Составляем электронный баланс
![]()
2) Определяем, что N+3 является восстановителем, вследствие отдачи электронов, Мn+7 - окислителем, вследствие принятия электронов.
3) Составляем уравнение реакции с учетом того, что в нейтральной среде МnO2 образуется перманганат-иона МnO4.
![]()
Задания для самостоятельной работы
139. Окислительные свойства оксид серы(IV) проявляет в реакции:
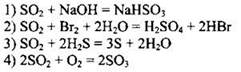
Ответ: ![]()
140. В реакции оксида вольфрама(VI) с водородом окислителем является
1) W+6
2) Н2O
3) O-2
4) W0
Ответ: ![]()
141. В реакции оксида марганца(II) с углеродом окислителем является
1) С0 .
2) О-2.
3) Мn+2.
4) Мn0
Ответ: ![]()
142. Хлор является и окислителем, и восстановителем в реакции, уравнение которой
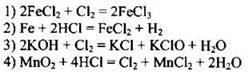
Ответ: ![]()
143. Азот проявляет свойства восстановителя в реакции, схема которой
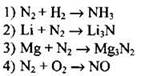
Ответ: ![]()
144. При взаимодействии с каким веществом оксид углерода(II) проявляет свойства восстановителя?
1) N2.
2) H2S.
3) Н2
4) Fe2O3
Ответ: ![]()
145. Бром проявляет свойства восстановителя в реакции, схема которой
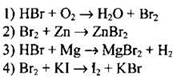
Ответ: ![]()
146. Окислительно-восстановительной не является реакция
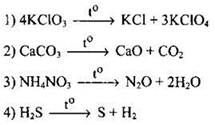
Ответ: ![]()
147. Углерод является окислителем в реакции с
1) водой
2) алюминием
3) оксидом меди(II)
4) серной кислотой
Ответ: ![]()
148. При взаимодействии с каким веществом оксид серы(IV) проявляет свойства окислителя?
1) оксидом натрия
2) гидроксидом бария
3) водой
4) сероводородом
Ответ: ![]()
149. В реакции магния с концентрированной азотной кислотой окислителем является
1) Mg2+
2) Н+. 3) Mg0
4) NO3 Ответ: 150. К окислительно-восстановительным относится реакция Ответ: 151. В реакции цинка с разбавленной серной кислотой восстановителем является 1) Zn0. 2) SO42-
3) Н+. 4) Zn2+ Ответ: 152. Сера является и окислителем, и восстановителем в реакции с 1) хлором 2) железом 3) гироксидом натрия 4) азотной кислотой Ответ: 153. Установите соответствие между схемой окислительно-восстановительной реакции и формулой вещества-восстановителя в ней. СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ Ответ: А Б В Г 154. Установите соответствие между уравнением окислительно-восстановительной реакции и веществом-окислителем в ней. УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ Ответ: А Б В Г 155. Установите соответствие между схемой окислительно-восстановительной реакции и веществом- восстановителем в ней. СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ Ответ: А Б В Г 156. Установите соответствие между схемой окислительно-восстановительной реакции и изменением степени окисления окислителя в ней. СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ Ответ: А Б В Г 157. Установите соответствие между схемой реакции и веществом-восстановителем в ней. СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ Ответ: А Б В Г 158. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней. УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ 1) от -2 до +4 2) от -2 до 0 3) от 0 до -2 4) от +6 до +4 5) от +4 до +6 Ответ: А Б В Г 159. Установите соответствие между уравнением реакции и формулой вещества, которое в данной реакции является окислителем. УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ Ответ: A Б В Г 160. Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в которой это изменение происходит. СХЕМА ИЗМЕНЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ УРАВНЕНИЕ РЕАКЦИИ Ответ: А Б В Г 161. Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции. УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО АЗОТА 1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не проявляет окислительно-восстановительных свойств Ответ: А Б В Г 162. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель. 163. Используя метод электронного баланса, составьте уравнение реакции Определите окислитель и восстановитель. 164. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель. 165. Используя метод электронного баланса, составьте уравнение реакции Определите окислитель и восстановитель. 166. Используя метод электронного баланса, составьте уравнение реакции Определите окислитель и восстановитель. 167. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель. 168. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель. 169. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель. 170. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель. 171. Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель.![]()
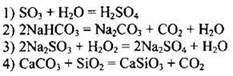
![]()
![]()
![]()
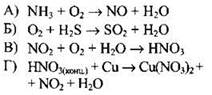

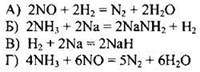
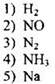
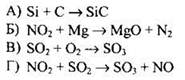

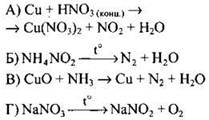
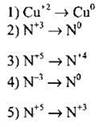
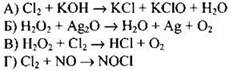

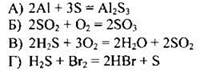
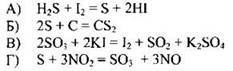

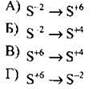
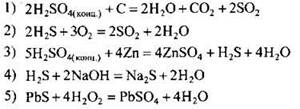
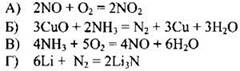
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()