Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия - Общие представления о промышленных способах получения важнейших веществ - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Тесты с выбором ответа с решениями
1. При производстве аммиака в качестве исходного сырья используется
1) “синтез-газ”
2) метан и воздух
3) метан и оксид углерода(II)
4) азот и оксид углерода(II)
2. В ходе синтеза аммиака по схеме ![]()
![]() равновесие реакции сдвигается в сторону продуктов реакции
равновесие реакции сдвигается в сторону продуктов реакции
1) при введении катализатора
2) при увеличении температуры
3) при повышении давления
4) при понижении давления
3. При производстве метанола в качестве сырья используется
1) азот и оксид углерода(II)
2) метан и воздух
3) метан и оксид углерода(II)
4) “синтез-газ”
4. В контактном аппарате идет
1) обжиг колчедана
2) растворение SO3 в конц. H2SO4
3) окисление SO2 до SO3
4) разбавление олеума
5. Принцип противотока используется
1) при растворении SO3 в конц. H2SO4
2) при окислении SO2 до SO3
3) при обжиге колчедана
4) при очистке печного газа от пыли
Тесты с выбором ответа для самостоятельного решения
6. При производстве аммиака исходную смесь газов берут в соотношении
1) 1 объем N2 к 3 объемам Н2
2) 3 объема N2 к 1 объему Н2
3) 5 объемов N2 к 1 объему Н2
4) 1 объем N2 к 5 объемам Н2
7. “Синтез-газ” — это смесь
1) углекислого газа и паров воды
2) углекислого газа и водорода
3) угарного газа и водорода
4) угарного газа и паров воды
8. “Метод кипящего слоя” используется
1) при окислении SO2 до SO3
2) при обжиге колчедана
3) при растворении SO3 в конц. H2SO4
4) при разбавлении олеума
9. Оксид ванадия(V) в качестве катализатора используется
1) при обжиге колчедана
2) при осушке печного газа
3) при растворении SO3 в конц. H2SO4
4) при окислении SO2 до SO3
10. При организации химических производств для наиболее полного использования теплоты химических реакций применяют следующие принципы
1) противоток (прямоток) веществ, введение катализатора, повышение давления, повышение концентрации реагирующих веществ
2) создание смежных производств (по переработке отходов)
3) теплообмен, утилизацию теплоты реакций
4) автоматизацию вредных производств, утилизацию отходов, нейтрализацию выбросов в атмосферу
Ответы на тесты раздела 4.2.2
1. 2 2. 3 3. 4 4. 3 5. 1 6. 1 7. 3 8. 2 9. 4 10. 3
Решения тестов раздела 4.2.2
Решение 1. В промышленности при производстве аммиака в качестве исходного сырья используют воздух и природный газ — метан. Воздух сжижают. Из жидкого воздуха первым испаряется азот, который и используют для синтеза аммиака. В ходе конверсии метана при 1300° С на никелевом катализаторе получают водород: ![]()
![]() Синтез аммиака проводят при 500-600° С и 32-100 МПа на железном катализаторе:
Синтез аммиака проводят при 500-600° С и 32-100 МПа на железном катализаторе: ![]() Из полученного аммиака можно получить азотную кислоту и ее соли:
Из полученного аммиака можно получить азотную кислоту и ее соли:
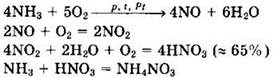
Ответ: 2.
Решение 2. Согласно правилу смещения равновесия система, находящаяся в равновесии, противодействует оказываемому на нее внешнему воздействию.
Реакция ![]() является экзотермической реакцией. В левой части реакции имеем 4 моль газов, в правой части реакции имеем 2 моль газов.
является экзотермической реакцией. В левой части реакции имеем 4 моль газов, в правой части реакции имеем 2 моль газов.
Введение катализатора не сдвигает равновесие реакции. Повышение температуры сдвигает равновесие в сторону той реакции, в ходе которой температура системы уменьшается, то есть в сторону эндотермической реакции, то есть в сторону исходных веществ. Повышение давления сдвигает равновесие в сторону той реакции, в ходе которой давление в системе уменьшается, то есть в сторону меньшего числа газообразных молекул, то есть равновесие сдвигается в сторону продуктов реакции. Понижение давления сдвигает равновесие в сторону той реакции, в ходе которой давление в системе увеличивается, то есть в сторону большего числа газообразных молекул, то есть равновесие сдвигается в сторону исходных веществ.
Ответ: 3.
Решение 3. “Синтез-газ” — это смесь оксида углерода(II) и водорода. Именно из этой смеси в промышленности получают метанол:
![]()
“Синтез-газ” может быть использован для получения различных жидких углеводородов:
![]()
Ответ: 4.
Решение 4. Получение серной кислоты контактным способом предусматривает три стадии. Первая стадия — получение сернистого газа, например, при обжиге пирита (серного колчедана) FeS2:
![]()
Обжиг пирита — это гетерогенный процесс. Для увеличения скорости этого процесса через размолотый пирит пропускают струю воздуха, и частицы пирита находятся во взвешенном состоянии — “кипящем слое”. Через печь для обжига проходят трубы с водой, которая отводит избыточное тепло, поскольку при перегреве может произойти спекание частиц пирита и нарушение процесса обжига. Полученный газ очищают в циклонах от пыли и сушат.
Вторая стадия — получение оксида серы(VI) (серного ангидрида) SO3 — происходит в контактном аппарате, где предварительно нагретые в теплообменнике газы контактируют с катализатором.
![]()
Третья стадия — получение серной кислоты. Полученный в контактном аппарате оксид серы(VI) поглощают безводной серной кислотой с получением олеума — раствора SO3 в H2SO4. Процесс идет в наполненной керамическими кольцами поглотительной башне с использованием принципа противотока: газ вдувают снизу башни, а кислота стекает сверху башни. Полученный олеум с водой дает концентрированную серную кислоту.
![]()
Ответ: 3.
Решение 5. Принцип противотока, как указано выше, используется при поглощении серного ангидрида SO3 серной кислотой.
Ответ: 1.