Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Общая характеристика неметаллов главных подгрупп IV-VII групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов - Периодический закон и периодическая система химических элементов Д.И. Менделеева - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. В ряду химических элементов N - О - F увеличивается
1) окислительная способность
2) радиус атомов
3) число электронных уровней
4) число s-электронов
2. В ряду: углерод — азот — фосфор электроотрицательность атомов
1) увеличивается
2) сначала увеличивается, потом уменьшается
3) уменьшается
4) сначала уменьшается, потом увеличивается
3. Электронная конфигурация внешней оболочки галогена
1) 4s24p3
2) 4s24p3
3) 4s24p5
4) 4s24p4
4. Числа неспаренных электронов на внешнем уровне атома серы в его основном, первом возбужденном и втором возбужденном состояниях равны соответственно
1) 6, 4 и 2
2) 0, 4, 6
3) 2, 4, 8
4) 2, 4 и 6
5. Высшая и низшая степени окисления азота в его соединениях равны соответственно
1) +5 и -3
2) -3 и +5
3) +3 и -3
4) -5 и +3
6. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s 2s 2р 3s 3р? А. Этот элемент образует соединение состава К2ЭO4. Б. Этот элемент не образует водородное соединение состава ЭН2.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Соединение состава КЭO4 образует элемент, атомы которого имеют конфигурацию внешнего уровня
1) 3s23p3
2) 3s23p4
3) 3s23p5
4) 3s23p2
8. Элемент, имеющий конфигурацию внешнего уровня 3s23p4, образует оксиды
1) ЭО и ЭO2
2) ЭO2 и ЭO3
3) Э2O3 и ЭO2
4) ЭО и ЭO3
9. Атом элемента содержит 34 протона. Кислота, образованная этим элементом в высшей степени окисления,
1) Н3ЭO3
2) Н2ЭO4
3) НЭO3
4) Н2ЭO3
10. Оксид состава ЭO2 образует каждый из двух элементов
1) углерод и фосфор
2) азот и фтор
3) углерод и сера
4) кремний и фтор
Тесты с выбором ответа для самостоятельного решения
11. В ряду: кремний — углерод — азот неметаллические свойства
1) увеличиваются
2) сначала увеличиваются, потом уменьшаются
3) уменьшаются
4) сначала уменьшаются, потом увеличиваются
12. Соединение состава К2НЭО4 образует элемент, атомы которого имеют конфигурацию внешнего уровня
1) Ss23p2
2) 3s23p3
3) 3s23p4
4) 3s23p5
13. Соединение состава ЭН4 образует элемент, атомы которого имеют конфигурацию внешнего уровня
1) 3s23p3
2) 3s23p4
3) 3s23p3
4) 3s23p2
14. Элемент, имеющий конфигурацию внешнего уровня 3s23p4, образует оксиды
1) ЭО и ЭO2
2) Э2O3 и ЭO2
3) ЭO2 и ЭO3
4) ЭО и ЭO3
15. Низшая и высшая степени окисления хлора в его соединениях равны соответственно
1) +7 и -1
2) -1 и +7
3) +5 и -1
4) -1 и +5
16. Число неспаренных электронов в основном состоянии атома фосфора равно
1) 1
2) 2
3) 3
4) 5
17. Степень окисления серы в соединениях с активными металлами равна
1) -2
2) 0
3) +4
4) +6
18. Окислительные свойства возрастают в ряду
1) углерод — азот — кислород
2) фосфор — азот — углерод
3) сера — кислород — фтор
4) хлор — фтор — кислород
19. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p63s23p2? А. Этот элемент не образует соединение состава К2ЭO4. Б. Этот элемент образует водородное соединение состава ЭН4.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
20. Элемент, образующий кислоту состава НЭO4, образует также водородное соединение состава
1) НЭ
2) Н2Э
3) ЭН3
4) ЭН4
Ответы на тесты раздела 1.2.4
1. 1 2. 2 3. 3 4. 4 5. 1 6. 2 7. 3 8. 2 9. 2 10. 3 11. 1 12. 2 13. 4 14. 3 15. 2 16. 3 17. 1 18. 3 19. 3 20. 1
Решения тестов раздела 1.2.4
Решение 1. В ряду N - О - F, то есть в периоде слева направо: окислительная способность (способность принимать электроны) усиливается, радиус атомов уменьшается, число электронных уровней, равное номеру периода 2, не меняется, число s-электронов, равное 2, не меняется.
Ответ: 1.
Решение 2. Электроотрицательность элементов увеличивается в периодах слева направо и уменьшается в главных подгруппах сверху вниз. Поэтому электроотрицательность в ряду углерод — азот увеличивается, а в ряду азот — фосфор уменьшается.
Ответ: 2.
Решение 3. Галогены — это элементы VIIA, группы: фтор, хлор, бром, иод. Атомы галогенов имеют на внешнем уровне семь электронов. Конфигурация их внешнего уровня ns2nр5. Этому условию соответствует оболочка 4s24p5, отвечающая атому брома.
Ответ: 3.
Решение 4. Электронная конфигурация атома серы: S (16ē) 1s22s22p63s23p43d°.
Запишем электронную конфигурацию внешнего уровня атома серы по квантовым ячейкам (орбиталям) для основного и двух возбужденных состояний и определим числа неспаренных электронов:
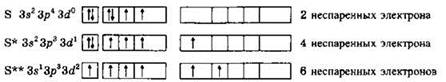
Ответ: 4.
Решение 5. Атом азота находится в VA группе периодической системы, имеет пять электронов на внешнем уровне и электронную формулу 1s22s22p3. Атом азота может максимально отдать пять электронов и принять три электрона. Атом азота имеет высшую степень окисления +5 и низшую степень окисления -3.
Ответ: 1.
Решение 6. Атом с электронной конфигурацией 1s 2s 2р 3s 3р — это фосфор. Атом фосфора имеет на внешнем уровне пять электронов, максимальная степень окисления фосфора +5. Зная, что степени окисления калия и кислорода в соединениях обычно равны соответственно +1 и -2, а сумма степеней окисления атомов в молекуле равна нулю, можно определить степень элемента Э в К2ЭO4. Находим, что степень окисления элемента +6. Это означает, что фосфор образовать соединение К2ЭO4 не может. Суждение А неверно. Фосфор имеет на внешнем уровне пять электронов и может иметь степень окисления -3, дополнив р-подуровень до шести электронов. Водородное соединение этого атома должно иметь формулу ЭН3. Суждение Б верно, поскольку фосфор не образует водородное соединение состава ЭН2.
Ответ: 2.
Решение 7. В соединении КЭO4 элемент Э имеет степень окисления +7. Такую степень окисления может иметь элемент, на внешнем уровне которого имеется семь электронов. Этому условию удовлетворяет элемент с конфигурацией внешнего уровня 3s23p5.
Ответ: 3.
Решение 8. Элемент с конфигурацией внешнего уровня 3s23p4 — это сера. Сера может иметь степени окисления +4, когда отданы р-электроны, и +6, когда отданы все валентные электроны. Этому условию отвечают оксиды серы SO2 и SO3.
Ответ: 2.
Решение 9. Элемент, атом которого содержит 34 протона, имеет порядковый номер 34. Этот элемент — селен. Селен находится в VIA группе, его высшая степень окисления +6. Только в одной из перечисленных в ответе кислот, а именно в Н2ЭО4, элемент Э имеет степень окисления +6.
Ответ: 2.
Решение 10. В оксидах степень окисления кислорода равна -2. Фтор не образует оксидов. Существует фторид кислорода OF2, степень окисления кислорода в котором равна +2. Поэтому ответы 2 и 4 не подходят. Фосфор находится в VA группе, имеет нечетные степени окисления +5 и +3 и соответствующие им оксиды Р2О5 и Р2О3, поэтому ответ 1 не подходит. Углерод находится в IVAгруппе, имеет степени окисления +4 и +2 и оксиды СO2 и СО. Сера находится в VIA группе, имеет степени окисления +6 и +4 и оксиды SO3 и SO2. Ответ 3 подходит: углерод и сера имеют оксиды состава СO2 и SO2.
Ответ: 3.