Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Электроотрицательность. Степень окисления и валентность химических элементов - Химическая связь и строение вещества - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. Из предложенного перечня выберите два элемента: наиболее электроотрицательный и наименее электроотрицательный:
1) Сl
2) О
3) Si
4) Вr
5) Аl
2. Из предложенного перечня выберите две молекулы: молекулу с наиболее полярной связью и молекулу с неполярной связью:
1) CF4
2) BF3
3) NF3
4) OF2
5) F2
3. В молекулах HF и CO2 частичный положительный заряд на атомах
1) Н и О
2) F и С
3) F и О
4) Н и С
4. В молекулах NH3 и SO3 частичный отрицательный заряд на атомах
1) N и О
2) Н и О
3) N и S
4) Н и С
5. Степень окисления элемента
1) всегда равна валентности этого элемента
2) это условный заряд атома в молекуле
3) равна номеру периода этого элемента
4) равна номеру группы этого элемента
6. Из предложенного перечня выберите два вещества, в которых степень окисления хрома равна +6:
1) К2Сr2O7
2) Cr2(SO4)3
3) CrSO4
4) К2СrO4
5) К3[Сr(ОН)б]
7. Из предложенного перечня выберите два вещества, в которых степень окисления хлора равна +3:
1) Ва(СlO2)2
2) РСl3
3) ClF3
4) КСlO3
5) Са(СlO4)2
8. Валентность элемента в соединении всегда равна
1) степени окисления этого элемента
2) числу образуемых им ковалентных связей
3) номеру периода этого элемента
4) номеру группы этого элемента
9. Степень окисления и валентность центрального атома численно по абсолютной величине не совпадают в молекуле
1) HNO2
2) HNO3
3) НРO3
4) Н3РО4
10. Из предложенного перечня выберите две молекулы, в которых степень окисления и валентность кислорода численно совпадают по абсолютной величине:
1) Na2O2
2) O2
3) Н2O2
4) OF2
5) Н2O
Тесты с выбором ответа для самостоятельного решения
11. Из предложенного перечня выберите два элемента: наименее электроотрицательный и наиболее электроотрицательный:
1) N
2) С
3) Н
4) Сl
5) F
12. В молекулах OF2 и H2S частичный положительный заряд на атомах
1) F и Н
2) О и Н
3) F и S
4) O и S
13. Из предложенного перечня выберите две молекулы: молекулу с наиболее полярной связью и молекулу с неполярной ковалентной связью:
1) СН4
2) NH3
3) Н2O
4) HF
5) Н2
14. Из предложенного перечня выберите два соединения, в которых степень окисления марганца равна +7:
1) Мn2O7
2) K2MnO4
3) Na3MnO4
4) KMnO4
5) MnSO4
15. Из предложенного перечня выберите два соединения, в каждом из которых имеется и железо со степенью окисления +3, и железо со степенью окисления +2:
1) K4[Fe(CN)6]
2) K3[Fe(CN)6]
3) K2FeO4
4) Fe3O4
5) KFe[Fe(CN)6]
16. В аммиаке NH3 степени окисления азота и водорода равны соответственно
1) +3 и -1
2) -3 и +1
3) +1 и -3
4) +1 и +3
17. Из предложенного перечня выберите две степени окисления водорода, которые водород имеет в соединениях с активными металлами и с активными неметаллами:
1) -1
2) +1
3) 0
4) +2
5) -2
18. Степень окисления и валентность хлора численно по абсолютной величине не совпадают в молекуле
1) Сl2
2) НСlO4
3) ССl4
4) НСlO
19. Наименьшую степень окисления хром имеет в соединении
1) Na2Cr2O7
2) CrSO4
3) К2СrO4
4) Na3[Cr(OH)6]
20. Элемент, проявляющий постоянную степень окисления в своих соединениях с другими элементами, — это
1) хлор
2) кислород
3) азот
4) фтор
Тесты с кратким ответом с решениями
21. Установите соответствие между формулой вещества и степенью окисления азота в ней.
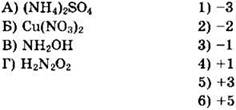
22. Установите соответствие между формулой соединения и степенью окисления хлора в ней.
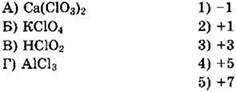
23. Установите соответствие между формулой соли и степенью окисления хрома в ней.
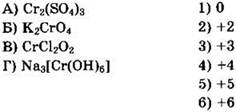
24. Установите соответствие между формулой вещества и степенью окисления серы в ней.
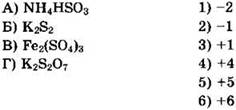
25. Установите соответствие между формулой вещества и степенью окисления углерода в ней.
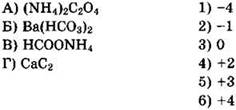
Тесты с кратким ответом для самостоятельного решения
26. Установите соответствие между формулой соединения и степенью окисления азота в ней.
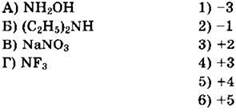
27. Установите соответствие между формулой соли и степенью окисления хрома в ней.
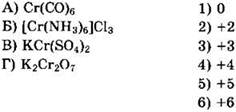
28. Установите соответствие между формулой вещества и степенью окисления углерода в ней.

29. Установите соответствие между формулой вещества и степенью окисления серы в ней.
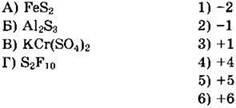
30. Установите соответствие между формулой соединения и степенью окисления хлора в ней.
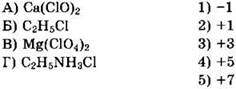
Ответы на тесты раздела 1.3.2
1. 25 2. 25 3. 4 4. 1 5. 2 6. 14 7. 13 8. 2 9. 2 10. 45 11. 35 12. 2 13. 45 14. 14 15. 45 16. 2 17. 12 18. 1 19. 2 20. 4 21. 1634 22. 4531 23. 3663 24. 4266 25. 5642 26. 2164 27. 1336 28. 4213 29. 2165 30. 2151
Решения тестов раздела 1.3.2
Решение 1. Электроотрицательность элемента — это способность атомов этого элемента удерживать электроны. Существуют таблицы электроотрицательностей элементов, однако для сравнения электроотрицательностей элементов можно использовать и периодическую систему элементов. В периодах слева направо электроотрицательность элемента увеличивается, в группах сверху вниз электроотрицательность элемента уменьшается. Наиболее электроотрицательный элемент — фтор. Следует запомнить, что кислород более электроотрицателен, чем хлор. Среди перечисленных элементов наиболее электроотрицателен кислород, а наименее электроотрицателен алюминий.
Ответ: 25.
Решение 2. Полярность связи определяется разностью электроотрицательностей атомов, образующих связь: чем больше эта разность, тем полярнее связь и тем больше величины соответствующих зарядов на атомах. Если разница электроотрицательностей равна нулю — то связь ковалентная неполярная. Если разница электроотрицательностей больше нуля, но меньше 1,5-2,0 — то связь ковалентная полярная. Если разница электроотрицательностей больше 1,5-2,0 — то связь ионная. Ионная связь — это предельный случай ковалентной полярной связи.
В молекулах, которые приведены в задании, атом фтора соединен с атомами углерода, бора, азота, кислорода и фтора, которые располагаются в одном периоде. Электроотрицательность этих атомов возрастает в ряду: бор — углерод — азот — кислород — фтор. Бор — наименее электроотрицателен, поэтому разница электроотрицательностей фтора и бора будет наибольшей, а связь B-F будет наиболее полярной. В молекуле F2 связь между одинаковыми атомами фтора будет неполярной ковалентной связью.
Ответ: 25.
Решение 3. При образовании ковалентной полярной связи общая пара электронов смещается в сторону более электроотрицательного атома, который приобретает частичный отрицательный заряд. При этом менее электроотрицательный атом приобретает частичный положительный заряд. В молекуле HF фтор более электроотрицателен, поэтому имеем следующее распределение зарядов: H+δF-δ, то есть положительный заряд находится на атоме водорода.
В молекуле СО2 кислород более электроотрицателен, поэтому имеем распределение зарядов: С+2δO-δ2, то есть положительный заряд находится на атоме углерода.
Ответ: 4.
Решение 4. В молекуле NH3 азот более электроотрицателен, поэтому имеем распределение зарядов: N-3δH+δ3, то есть отрицательный заряд находится на атоме азота. В молекуле SO3 кислород более электроотрицателен, поэтому имеем следующее распределение зарядов: S+3δO-δ3, то есть отрицательный заряд находится на атоме кислорода.
Ответ: 1.
Решение 5. Степень окисления — это условный заряд атома в молекуле, где полярные связи считаются ионными. Степень окисления элемента в его простых веществах равна нулю. Номер группы численно равен только наивысшей степени окисления элемента.
Ответ: 2.
Решение 6. Некоторые атомы имеют в соединениях с другими атомами постоянные степени окисления: +1 (Li, Na, К), +2 (Mg, Са, Ва), +3 (Al), -1 (F). Кислород обычно имеет в соединениях степень окисления -2, например в Н2O, но может иметь и другие степени окисления: -1 (Н2О2), О (O2), +2 (OF2). Водород обычно имеет степень окисления +1 (НСl), но может иметь степени окисления О (Н2), -1 (NaH).
В соединении К2Сr2O7 калий имеет степень окисления +1, а кислород -2. Следует помнить, что сумма степеней окисления атомов в молекуле равна нулю. Принимаем степень окисления хрома за +х, определяем сумму степеней окисления атомов в этом соединении и приравниваем эту сумму к нулю: 2(+1) + 2(+х) + 7(-2) = 0. Отсюда 2 + 2х - 14 = 0, 2х = 12, х = +6. Аналогично находим степени окисления хрома в Сr2(SO4)3 (Сr+3), в CrSO4 (Сr+2), в К2СrO4 (Сr+6), в К3[Сr(ОН)6] (Сr+3).
Ответ: 14.
Решение 7. В соединении Ва(СlO2)2 барий имеет степень окисления +2, а кислород -2. Сумма степеней окисления атомов в молекуле равна нулю. Принимаем степень окисления хлора за +х, определяем сумму степеней окисления атомов в этом соединении и приравниваем эту сумму к нулю: 1(+2) + 2(+x) + 4(-2) = 0. Отсюда 2 + 2х - 8 = 0, 2х = 6, х = +3. В соединении РСl3 хлор более электроотрицателен, чем фосфор и имеет степень окисления -1, а фосфор имеет степень окисления +3. В соединении ClF3 фтор более электроотрицателен, чем хлор, и имеет степень окисления -1, а хлор имеет степень окисления +3. Степени окисления хлора в КСlO3 и Са(СlO4)2 равны +5 и +7 соответственно.
Ответ: 13.
Решение 8. Валентность характеризует способность атома образовывать химические связи. Валентность равна числу ковалентных связей, образованных атомом. Ковалентная связь — это связь с помощью общих пар электронов, образованных из неспаренных электронов двух атомов. Валентность атома может быть определена как число неспаренных электронов на внешнем уровне атома в его основном или возбужденном состоянии. Например, атом углерода в возбужденном состоянии имеет четыре неспаренных электрона, с неспаренными электронами других атомов он может образовать четыре общие пары электронов, то есть четыре связи. Отсюда валентность углерода равна четырем.
Ответ: 2.
Решение 9. Поскольку валентность атома равна числу образованных этим атомом ковалентных связей, то для определения валентности следует нарисовать графическую формулу соединения. В графических формулах показывают порядок соединения атомов в молекуле и валентности атомов. Углы между связями изображают произвольно. Следует помнить, что в молекулах кислородсодержащих кислот кислые атомы водорода соединяются с элементом, образующим кислоту через кислород.
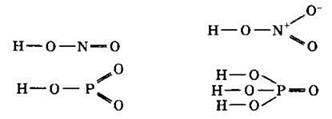
Из приведенных формул видно, что валентность азота в азотистой кислоте HNO2 равна III, в азотной кислоте HNO3 равна IV. Валентность фосфора в метафосфорной кислоте НРО3 и ортофосфорной кислоте равна V. Азот имеет на внешнем уровне только одну 2s- и три 2р-орбитали, на которых располагаются пять электронов. В основном состоянии азот имеет три неспаренных электрона и его валентность равна трем. Иметь пять неспаренных электронов азот не может. Валентность азота равна четырем. У фосфора на внешнем уровне имеются не только одна 3s- и три 3р-орбитали, но и вакантные 3d-орбитали. Это позволяет фосфору иметь пять неспаренных электронов и валентность V.
Степени окисления азота в HNO2 и HNO3 равны +3 и +5 соответственно. Степени окисления фосфора в НРО3 и Н3РO4 равны +5.
Отсюда следует, что для азотной кислоты HNO3 валентность азота IV численно не совпадает по абсолютной величине со степенью окисления азота +5.
Ответ: 2.
Решение 10. Решение аналогично решению предыдущей задачи. Записываем графические формулы соединений: Na-O-O-Na, O=O, Н-О-О-Н, F-O-F, Н-О-Н. Видно, что во всех соединениях кислород образует по две связи и имеет валентность II.
Степени окисления кислорода равны: -1 (Na2O2), 0 (O2), +2 (OF2), -1 (Н2O2) и -2 (Н2O).
Отсюда следует, что валентность II численно совпадает по абсолютной величине со степенью окисления кислорода +2 для фторида кислорода OF2 и со степенью окисления кислорода -2 для воды Н2O.
Ответ: 45.
Решение 21. Полезно помнить, что азот может иметь в соединениях все степени окисления от -3 до +5. Для решения этой и следующих задач этого раздела надо определить степени окисления элементов в имеющихся соединениях. Из формулы (NH4)2SO4 следует, что ион аммония имеет заряд 1+, а сульфат-ион — заряд 2-. Значит, сумма зарядов в ионе аммония равна +1, при этом водород как менее электроотрицательный по сравнению с азотом элемент имеет степень окисления +1. Принимаем степень окисления азота за х и определяем сумму зарядов атомов в ионе аммония NH4+: 1(x) + 4(+1) = +1, х + 4 = 1, х = -3. Ответ 1.
Для Сu(NО3)2 имеем степень окисления меди +2 и степень окисления кислорода -2. Принимаем степень окисления азота за х и определяем сумму зарядов атомов в Сu(NО3)2, помня, что сумма степеней окисления атомов в молекуле равна нулю: 1(+2) + 2(х) + 6(-2) = 0, 2 + 2х - 12 = О, х = +5. Ответ 6.
В заданиях повышенной сложности могут встретиться вещества, которые в школьной программе не изучались. К таким веществам относится гидроксиламин NH2OH и азотноватистая кислота H2N2O2 (HON=NOH). Это не должно мешать определению степеней окисления в этих молекулах, поскольку в этих молекулах кислород имеет степень окисления -2, а водород — +1. Принимаем степень окисления азота за х и определяем сумму зарядов атомов в NH2OH:
1(х) + 2(+1) + 1(-2) + 1(+1) = 0, x + 2 - 2 + 1 = 0, x = -1. Ответ 3.
Аналогично для H2N2O2 имеем: 2(+1) + 2(х) + 2(-2) = 0, 2 + 2х - 4 = 0, 2х = 2, х = +1. Ответ 4.
Общий ответ: 1634.
Решение 22. Аналогично рассмотренному в решении предыдущей задачи находим степень окисления хлора для Са(СlO3)2: 1(+2) + 2(х) - 6(-2) = 0, 2 + 2х - 12 = 0, 2х = 10, х = +5. Ответ 4.
Находим степень окисления хлора для КСlO4: 1(+1) + 1(x) + 4(-2) = 0, 1 + x - 8 = 0, х = +7. Ответ 5. Находим степень окисления хлора для HClO2: 1(+1) + 1(x) + 2(-2) = 0, 1 + x - 4 = 0, х = +3. Ответ 3. Находим степень окисления хлора для АlСl3, помня, что алюминий имеет в соединениях степень окисления +3: 1(+3) + 3(x) = 0, 3 + 3х = 0, х = -1. Ответ 1. Следует помнить, что в соединениях с атомами менее электроотрицательных элементов (металлы, углерод и др.) хлор всегда имеет степень окисления -1.
Общий ответ: 4531.
Решение 23. Полезно помнить, что характерными степенями окисления хрома в соединениях являются: +2, +3 и +6. Определяем степень окисления хрома в каждом из перечисленных соединений. Для Cr2(SO4)3нужно помнить, что сульфат-ион имеет заряд 2-. Принимая степень окисления хрома за х, находим 2(х) + 3(-2) = 0, 2х - 6 = 0, х = +3. Ответ: 3. Для К2СrO4 находим: 2(+1) + 1(х) + 4(-2) = 0,2 + x - 8 = 0, x = +6. Ответ: 6. Для СrСl2O2 находим: 1(x) + 2(-1) + 2(-2) = 0, 1х - 2 - 4 = 0, х = +6. Ответ: 6. Для Na3[Cr(OH)6] находим: 3(+1) + 1(x) + 6(-2) + 6(+1) = 0, 3 + x - 12 + 6 = 0, х = +3. Ответ: 3.
Общий ответ: 3663.
Решение 24. Полезно помнить, что характерными степенями окисления серы в соединениях являются: -2, +4 и +6. Для соединения NH4HSO3, учитывая, что ион аммония имеет заряд 1+, находим: 1(+1) + 1(+1) + 1(x) + 3(-2) = 0, 1 + 1 + x - 6 = 0, х = +4. Ответ: 4. Для дисульфида калия K2S2 находим: 2(+1) + 2(х) = 0, 2 + 2х = 0, х = -1. Ответ: 2. Из формулы Fe2(SO4)3видно, что сульфат-ион имеет заряд 2-. Для иона SO42- находим: 1(x) + 4(-2) = -2, х - 8 = -2, х = +6. Ответ: 6. Для соединения K2S2O7 имеем: 2(+1) + 2(х) + 7(-2) = 0, 2 + 2х - 14 = 0, х = +6. Ответ: 6.
Общий ответ: 4266.
Решение 25. Учитывая, что ион аммония имеет заряд 1+, находим для оксалата аммония (NH4)2C2O4: 2(+1) + 2(х) + 4(-2) = 0, 2 + 2х - 8 = 0, х = +3. Ответ: 5. Из формулы Ва(НСO3)2 видно, что гидрокарбонат-ион имеет заряд 1-. Находим для НСO3-: 1(+1) + 1(x) + 3(-2) = -1, 1 + x - 6 = -1, х = +4. Ответ: 6. Ион аммония имеет заряд 1+, отсюда формиат-ион имеет заряд 1-. Для формиат-иона НСОО- имеем: 1(+1) + 1(x) + 2(-2) = -1, 1 + х - 4 = -1, х = +2. Ответ: 4. Для соединения СаС2 имеем: 1(+2) + 2(х) = 0, 2 + 2х = О, х = -1. Ответ: 2.
Общий ответ: 5642.