Химия и повседневная жизнь человека - поурочные разработки
Стирка по-научному - Сценарии уроков на основе проблемных заданий
Цели урока. В занимательной форме повторить и обобщить изученный материал по химии; научить применять полученные знания для решения бытовых проблем, связанных со стиркой, а также извлекать информацию прикладного характера из учебника химии; познакомить учащихся со свойствами некоторых соединений, изучение которых не предусмотрено программой, но которые очень широко используются в быту (биодобавки для стиральных порошков, «Персоль»).
Оборудование. Карточки-задания для учащихся, образцы воды разной степени жесткости (колодезная, дождевая, снеговая или дистиллированная), образцы различных моющих средств (стиральные порошки обычные, с отбеливателями, с биодобавками, хозяйственное мыло, кальцинированная сода, питьевая сода, отбеливатели перекисные и хлорсодержащие, например «Персоль» и «Белизна»), образцы тканей (белых и цветных, хлопковых и шерстяных) с пятнами различного происхождения, фарфоровые чашки, химические стаканы, электроплитка, ультрафиолетовая лампа, учебники по химии и по технологии, другая дополнительная литература.
Методические рекомендации по проведению урока
Все задания урока можно использовать в 11 классе, а в сокращенном варианте (задания 1.8, 1.10, 1.12, 1.20, 1.23) — ив 9-м, при повторении и обобщении материала по неорганической химии.
Урок можно проводить как чисто теоретический, однако лучше включить демонстрационные опыты, примерная тематика которых приведена ниже:
1. Удаление пятен различного происхождения с помощью «Персоли», лимонной кислоты, зубного порошка, стиральных порошков с биодобавками, бензина, спирта.
2. Обесцвечивание пятен от морковного сока под действием УФ-облучения.
3. Удаление пятен йода путем возгонки.
4. Растворимость мыла в воде различной жесткости.
Введением (эпиграфом) к уроку может послужить анекдот «Замкнутый круг». Если вы ждете гостей и вдруг заметили на своем костюме пятно, не огорчайтесь. Это поправимо. Например, пятна от растительного масла легко выводятся бензином. Пятна от бензина легко снимаются раствором щелочи. Пятна от щелочи исчезают от уксусной эссенции. Следы от уксусной эссенции надо потереть подсолнечным маслом. Ну а как выводить пятна от подсолнечного масла, вы уже знаете.
Задания
1.1. В 50-е гг. XX в., когда еще не появились стиральные порошки на основе синтетических моющих средств, многие женщины кипятили белое белье в растворе силикатного клея. Как можно объяснить моющие свойства силикатного клея?
1.2. Вам пришлось стирать темные вещи с мылом в жесткой воде. После стирки и полоскания на них остался «седой» налет. Как его устранить и что можно было сделать, чтобы этого не произошло?
1.3. Одна хозяйка, готовясь к стирке, подогревала воду так, как показано на рисунке 1, а другая так, как показано на рисунке 2. Какая из хозяек поступила неправильно? В чем заключается ее ошибка и к каким последствиям она может привести? Можно ли считать ее действия опасными?
Рис. 1
Рис. 2
1.4. Две хозяйки готовились к стирке. Первая подогрела воду до 60 °С и замочила в ней белье, вторая нагрела воду до кипения, прокипятила ее 5 мин, а затем охладила до 60 °С и только после этого начала стирку. У кого белье лучше отстирается? Каким простым опытом это можно доказать и как объяснить?
1.5. Вы прокипятили белое белье со стиральным порошком и содой в старом баке из оцинкованной жести и обнаружили, что на белье, которое находилось на дне бака, появились желтые пятна, а на стенках бака — белый рыхлый налет. Почему это произошло? Напишите уравнения реакций. Как можно удалить пятна с белья и налет со стенок бака? Что надо было сделать, чтобы не испортить белье?
1.6. В вашем доме есть бутыль с жидким отбеливателем, но этикетка с инструкцией потеряна. Препарат имеет запах хлора. Вы решили обработать им белье без нагревания. Какую посуду вы выберете, если у вас есть: новое ведро из оцинкованной жести, старый эмалированный бак с поврежденной эмалью, пластмассовый таз?
1.7. Вам надо удалить свежие пятна подсолнечного масла и йода. Можно ли сделать это физическим способом, не прибегая к помощи химии?
1.8. Если вы посадили на одежду жирное пятно за праздничным столом и нет возможности сразу же заняться его выведением, рекомендуется немедленно засыпать пятно солью. Иногда после такой обработки пятно полностью исчезает. К каким способам выведения можно отнести этот прием — к физическим или к химическим?
1.9. Пятно от смолы или садового вара с одежды иногда удается вывести очень простым способом: проглаживанием горячим утюгом, проложив с обеих сторон пятна плотную ткань или фильтровальную бумагу, которые надо постоянно менять. Какие при этом происходят процессы и к каким явлениям они относятся — физическим или химическим?
1.10. Вам надо удалить со скатерти пятно от мясного соуса. Соседка посоветовала прокипятить скатерть в порошке «Био-С», но пятно не исчезло. Почему? Можно ли было все-таки удалить это пятно с помощью биопорошка?
Подсказка. Инструкция на коробке порошка, а также следующая информация: энзимы биологические катализаторы, регулирующие биохимические процессы в живых организмах.
1.11. Вы пролили йод на белую салфетку. Попытались вывести пятно с помощью отбеливателей: «Персоли», затем хлорной извести, но неудачно — ни одно из этих средств не обесцветило пятно. Однако через несколько дней пятно исчезло. Можно ли написать уравнение реакции, благодаря которой исчезло пятно? Почему оно не исчезло под действием «Персоли» и хлорной извести? Если необходимо быстро удалить пятно йода с ткани, то какое химическое соединение надо использовать — с окислительными или с восстановительными свойствами?
1.12. Вы пролили на скатерть подсолнечное масло и сразу же не смогли заняться удалением пятна. Когда через 10 дней вы вспомнили о скатерти, пятно стало интенсивно желтым. Попытка убрать его с помощью бензина не привела к успеху. Соседка посоветовала вам вывесить скатерть на солнце на несколько часов, так как некоторые пятна после этого исчезают. Почему бензин не удалил пятно со скатерти и хороший ли совет дала вам соседка?
1.13. Вам надо удалить пятна различного происхождения: сливочное масло (свежее пятно), кофе, йод, морковный сок, аптечный препарат «зеленка», вишневый сок, мясной соус. Имеются следующие средства: «Персоль», стиральный порошок «Био-С», УФ-лампа, зубной порошок, бензин. Подберите для каждого пятна средства выведения.
1.14. В инструкциях к стиральным порошкам и пастам с биологически активными добавками («Био-С», «Е» и др.) обычно указано, что эти средства не рекомендуется применять для стирки изделий из натурального шелка и шерсти. Однако некоторые хозяйки специально стирают такими средствами одежду из грубой домашней шерсти и считают, что после стирки вещи становятся более мягкими и пушистыми. Действительно ли такое возможно или это только кажется хозяйкам? И как все-таки следует поступать — соблюдать инструкцию или не обращать на нее внимания?
1.15. Как вы думаете, слово «персоль» правильнее употреблять в женском роде или в мужском?
1.16. Процесс стирки, т. е. удаления загрязнений с волокон ткани, с точки зрения химии протекает абсолютно одинаково для всех видов тканей. Можно ли сказать то же самое о процессе высыхания после стирки изделий из хлопчатобумажных волокон и из чистошерстяных?
Подсказка. В учебниках (свойства белков, целлюлозы).
1.17. Почему трикотажные изделия из натуральной шерсти очень сильно вытягиваются и теряют форму после стирки, если сушить их в подвешенном состоянии, а хлопчатобумажный трикотаж можно сушить таким способом, и он при этом не теряет формы?
1.18. Изделия из натуральной шерсти нельзя отбеливать кислородсодержащими отбеливателями, но можно отбеливать препаратами на основе гидросульфита натрия NaHSО3 (например, «Лилия»). Хозяйки, которые пользуются этими средствами, замечают, что отбеленные вещи приобретают неприятный запах, и этот же запах имеет раствор в процессе отбеливания. Чем обусловлено появление неприятного запаха при использовании отбеливателей этого типа? Безопасно ли для здоровья пользоваться ими?
1.19. Во многие современные стиральные порошки добавляют безводный сульфат натрия для сохранения сыпучести. За счет какого процесса эта соль предотвращает слеживаемость порошком?
1.20. На коробке стирального порошки «Ариэль» приведена таблица, в одном столбце которой перечислены входящие в состав порошка компоненты, а в другом указаны их функции. Подберите каждому компоненту его функцию из приведенного перечня.
Компоненты:
• анионные поверхностно-активные вещества;
• перборат натрия (NaBО2 · Н2О2 · 3Н2О — содержит пероксигруппу);
• энзимы, фосфаты;
• карбонаты и силикаты;
• сульфат натрия;
• отдушки.
Функции:
• смягчают воду и тем самым повышают эффективность порошка;
• устанавливают кислотно-щелочной баланс моющей жидкости, обеспечивая лучшее качество стирки;
• придают приятный запах моющему раствору и одежде;
• обеспечивают хорошую сыпучесть порошка;
• удаляют пятна кофе, чая, фруктов;
• очищают грязь с ткани;
• биологически разрушают пятна веществ, содержащих белок.
1.21. Если вы отбеливаете белье «Персолью», следует ли закрывать бачок крышкой или это не влияет на процесс отбеливания?
1.22. Почему стиральные порошки с биологически активными добавками особенно сильно разъедают руки?
1.23. Кухонные полотенца часто бывают испачканы сажей, особенно если пищу готовят на дровяной плите. Как можно вывести пятна сажи? Помогут ли современные стиральные порошки с отбеливателями?
1.24. Многие хозяйки знают, что освежить залоснившийся воротник пиджака можно, протерев его кусочком поролона, смоченным в нашатырном спирте. При этом NH3 • Н2О, как и щелочи, разлагает жиры, которые в данном случае и являются основным загрязняющим веществом. Почему для этой цели не рекомендуют использовать раствор соды?
1.25. Почему зимой белье рекомендуют полоскать в соленой воде, если предполагается сушить его на открытом воздухе?
1.26. Опытные хозяйки стараются не накапливать грязное белье, а стирать его как можно скорее и никогда не гладят несвежую, загрязненную одежду. Как можно объяснить это с точки зрения химии?
Ответы и решения
1.1. Силикатный клей представляет собой водный раствор соли — силиката натрия Na2SiО3, — которая подвергается гидролизу:
![]()
за счет чего раствор имеет щелочную реакцию. Образующаяся в результате гидролиза щелочь эмульгирует и частично омыляет жиры. Так что действие силикатного клея аналогично действию соды и мыла. Поэтому не спешите выбрасывать пузырьки с засохшим силикатным клеем: его можно размочить и использовать для стирки и кипячения сильно загрязненного белого белья.
1.2. Мыло в жесткой воде плохо мылится и образует осадок стеарата кальция:
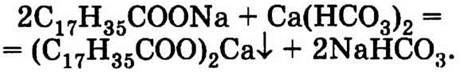
Этот осадок и проступает на темных тканях в виде «седого» налета.
Чтобы этого не произошло, следует смягчить воду, добавив в нее соду или прокипятив.
Избавиться от «седого» налета можно, если прополоскать вещи в разбавленном растворе уксусной кислоты:
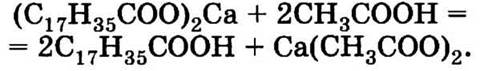
1.3. Для горения газовой горелки необходим хороший доступ воздуха. Если поставить бак с широким дном на низкую подставку, доступ воздуха к горелке будет затруднен и она может погаснуть. Если сразу же не перекрыть подачу газа, он будет накапливаться в помещении, что может привести к взрыву.
Возможно также неполное сгорание метана, приводящее к образованию оксида углерода (II):
![]()
Накапливаясь в помещении, оксид углерода (II) может стать причиной сильного отравления. Этот газ часто называют «угарным газом», так как именно он вызывает «угорание» в банях, в домах с печным отоплением при неправильной эксплуатации дровяных печей. Так что действия второй хозяйки можно считать опасными.
1.4. Мыло и другие моющие средства намного эффективнее действуют в мягкой воде. Жесткость воды обусловлена присутствием в ней гидрокарбонатов кальция и магния, которые при кипячении выпадают в осадок в виде карбонатов:
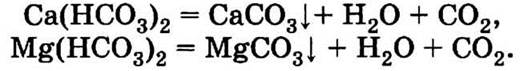
При нагревании воды до температуры 60 °С эти реакции не происходят, и вода остается жесткой. Так что белье лучше отстирается у той хозяйки, которая прокипятила воду. Это легко доказать простым опытом: опустить по кусочку мыла в подогретую воду и воду той же температуры, но прокипяченную. В прокипяченной воде мыло растворяется почти без осадка, а в сырой воде образуется осадок в виде хлопьев. Образование осадка стеаратов кальция и магния происходит за счет взаимодействия растворенных солей кальция и магния с мылом.
Следует помнить, что кипячение устраняет только карбонатную, или временную, жесткость воды, а постоянная жесткость, обусловленная присутствием сульфатов и хлоридов кальция и магния, может быть устранена только действием соды:
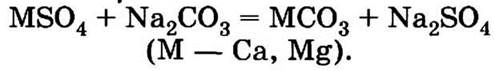
1.5. Раствор в баке имеет щелочную реакцию вследствие гидролиза соды:
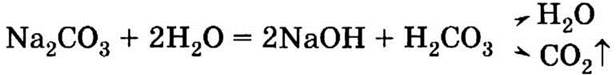
Цинк — химически активный металл, легко растворяется в кислотах, а при нагревании и в щелочах:
![]()
Кроме того, необходимо учитывать, что оцинкованная поверхность бака покрыта тонкой пленкой оксида цинка, который является амфотерным оксидом и может растворяться как в кислотах, так и в щелочах. В щелочной среде при нагревании происходит реакция, уравнение которой
![]()
так что белый рыхлый налет на стенках бака — это цинкаты натрия. Возможно также присутствие в налете гидроксида цинка Zn(OH)2.
Растворить этот налет можно в любой слабой кислоте, например в уксусной, или в разбавленном растворе хлороводорода (соляной кислоте):
![]()
При длительном использовании бачка тонкий слой цинка постепенно растворяется, и обнажаются участки жести. Жесть, как и все сплавы железа, легко подвергается коррозии с образованием соединения Fe2О3 · nН2O, или FeO(OH), которое и обусловливает цвет ржавчины. Так что желтые пятна на белье — это следы ржавчины, или гидратов оксида трехвалентного железа. Вывести эти пятна непросто, так как все соединения Fe3+ имеют интенсивную желтую окраску. Обесцветить их можно, капнув несколько капель лимонного сока или раствора лимонной кислоты, так как лимонная кислота образует с Fe3+ бесцветные комплексные соединения. Чтобы не испортить белье, надо положить на дно бака тряпку, чтобы более ценные предметы не соприкасались с ржавчиной.
1.6. В качестве хлорсодержащего отбеливающего средства чаще всего используют водные растворы гипохлоритов — солей хлорноватистой кислоты НСlO, которые получают пропусканием хлора через раствор щелочи:
![]()
Образующийся при этом водный раствор, содержащий NaCl и NaClO, под названием «жавелевая вода» используют для отбеливания тканей очень давно. Отбеливание происходит за счет окисления загрязняющих веществ хлорноватистой кислотой, которая из растворов гипохлоритов вытесняется угольной кислотой и легко разлагается:
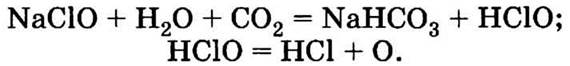
Таким образом, в отбеливающем растворе присутствуют хлорноватистая и соляная кислоты.
Если налить такой отбеливатель в ведро из оцинкованной жести, то присутствующие в нем кислоты сначала будут растворять оксидную пленку цинка, а затем взаимодействовать непосредственно с цинком. Если использовать эмалированную емкость с поврежденной эмалью, эти кислоты будут взаимодействовать с железом (эмалированная посуда изготовлена из сплавов железа).
Выделяющийся при разложении НСlO атомарный кислород также окисляет цинк и железо. Кроме того, все отбеливающие средства на основе соединений хлора могут содержать и некоторое количество свободного хлора, который также будет окислять металлы:
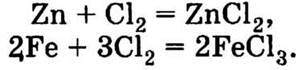
Для отбеливания белья следует выбрать пластмассовый таз, так как все остальные материалы будут вступать в химическое взаимодействие с отбеливателем. Но надо иметь в виду, что, если полимерные материалы длительное время подвергаются воздействию сильных окислителей, они становятся хрупкими и постепенно разрушаются.
1.7. Да, можно. Прежде всего следует попытаться оба пятна удалить органическим растворителем — бензином, керосином. В данном случае будет происходить физический процесс растворения. И йод, и растительное масло хорошо растворяются в органических растворителях.
Пятно йода проще всего удалить за счет способности этого вещества легко возгоняться. Ткань следует слегка подогреть, например утюгом или на батарее отопления, — это ускорит процесс возгонки.
1.8. Это физический способ, так как соль не вступает в химическое взаимодействие с жирами, а только адсорбирует их.
1.9. При нагревании сначала происходит плавление смолы или вара, а затем их адсорбция (поглощение) фильтровальной бумагой. Оба эти процесса относятся к физическим явлениям.
1.10. Поскольку энзимы регулируют биохимические процессы в живых организмах, они действуют только при температурах, не превышающих температуру тела теплокровных животных. Кроме того, энзимы — вещества белковой природы, и при кипячении с ними происходят необратимые процессы — денатурация. Поэтому стирать этими порошками следует при температурах не выше 40 °С, как и написано в инструкции. Если замочить скатерть в теплой воде с этим порошком на 2 ч, то пятно исчезнет.
1.11. Нет, уравнения реакции написать нельзя, так как пятно исчезло в результате физического процесса — постепенной сублимации йода, адсорбированного тканью. Хлорная известь Са(СlO)2 и «Персоль» Na2CO3 · 1,5Н2O2 · Н2O обладают окислительными свойствами, поэтому они не обесцветили пятно йода, так как йод тоже является окислителем. Можно попытаться вывести такое пятно с помощью восстановителей, например водного раствора сульфита натрия Na2SO3:
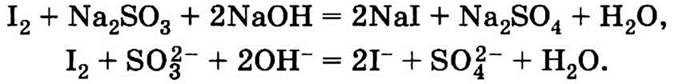
1.12, Растительные жиры состоят преимущественно из непредельных соединений, в их молекулах имеются двойные связи, и они могут полимеризоваться, как все соединения с двойными связями. За счет этих процессов происходит, например, высыхание масляных красок с образованием прочного покрытия, так как все олифы изготовлены на основе растительных масел. При старении пятна растительного масла, особенно на свету и при повышенных температурах, не только образуются прочные полимерные молекулы, но также за счет двойных связей происходит взаимодействие молекул жира с полимерными молекулами ткани. Вывести такое пятно очень трудно.
1.13. Сливочное масло (свежее пятно) легко удалить бензином или зубным порошком.
Кофе, морковный сок, аптечный препарат «зеленка», вишневый сок обесцвечиваются под действием «Персоли».
Мясной соус можно отстирать порошком «Био-С», содержащим ферменты.
Пятна от морковного сока, в котором много каротина, обусловливающего его окраску, обесцвечиваются на солнце, так как каротин — природный светочувствительный пигмент, значит, их можно быстро вывести с помощью УФ-лампы.
Пятно йода можно вывести бензином, а также путем возгонки йода с ткани при нагревании.
1.14. Энзимы, или ферменты,— катализаторы реакций в живых организмах. Особую роль играют ферменты в пищеварении. Например, переваривание пищи, особенно белковой, было бы невозможно без участия ферментов.
В стиральные порошки и пасты ферменты добавляются для того, чтобы они могли удалять загрязнения белкового происхождения — пятна крови, мясного соуса и т. д., поэтому подбирают именно те ферменты, которые разлагают белки. Поскольку шерсть и натуральный шелк также являются веществами белкового происхождения, обработка их такими стиральными средствами приводит к постепенному разрыву химических связей в белковых молекулах и уменьшению прочности волокон. Химику следует помнить, что ферменты, входящие в состав стиральных порошков, разрушают пептидные связи, которые присутствуют в молекулах всех белковых соединений, а на мостиковые связи —S—S—, характерные для кератинов, эти ферменты не действуют. (Схематическое изображение всех типов связей в молекулах кератина представлено в приложении 1.) Частичное разрушение связей в молекулах кератина, из которого преимущественно и состоит шерсть, приводит к размягчению волокон, и все изделие становится более мягким, что очень важно для грубой домашней пряжи. Так что правы и те хозяйки, которые стирают грубую шерсть в биопорошках, и инструкция на пачке порошка.
1.15. «Персоль» — сокращение от «перекисная соль», а слово «соль» в русском языке относится к женскому роду.
1.16. Изделия из хлопчатобумажных (целлюлозных) волокон высыхают в результате физического процесса — испарения воды, так как в целлюлозе не происходит химических превращений под действием воды в процессе стирки.
Натуральная шерсть с точки зрения химии представляет собой кератин — фибриллярный белок, физические свойства которого обусловлены наличием различных типов химических связей между белковыми цепями (см. урок «Химик в парикмахерской»). Водородные связи и солевые мостики разрушаются под действием воды, уменьшая жесткость белковых цепей, поэтому во влажном состоянии все трикотажные шерстяные вещи очень сильно растягиваются. При их высыхании не только испаряется вода из промежутков между волокнами, но и восстанавливаются водородные связи и солевые мостики между белковыми цепями, т. е. происходят химические процессы.
Таким образом, если высыхание хлопчатобумажных вещей — физический процесс, то высыхание шерстяных изделий сопровождается обратимыми химическими превращениями.
1.17. См. ответ к заданию 1.16.
1.18. Гидросульфит натрия в водных растворах при нагревании разлагается:
![]()
Неустойчивая сернистая кислота H2SO3, в свою очередь, разлагается с выделением оксида серы (IV) SO2. Именно этот газ и является отбеливающим агентом, так как соединения серы (IV) при взаимодействии с более сильными восстановителями проявляют окислительные свойства.
Выделяющийся SO2 обусловливает, неприятный запах раствора и обработанных им вещей. Оксид серы (IV) — сернистый газ — не является безвредным для человека, так как он раздражает слизистую оболочку дыхательных путей за счет образования кислоты:
![]()
Поэтому отбеливание лучше проводить в закрытой емкости и в хорошо проветриваемом помещении.
1.19. Сульфат натрия легко образует очень прочный кристаллогидрат состава Na2SO4 · 10Н2O, связывая 10 молекул воды. Поэтому безводный Na2SO4 хорошо поглощает влагу, предотвращая слеживаемость порошков.
1.20. Анионные поверхностно-активные вещества очищают грязь с ткани;
• перборат натрия — кислородсодержащий отбеливатель, удаляющий пятна чая, кофе, фруктов;
• энзимы — биологически разрушают белковые загрязнения;
• фосфаты смягчают воду (частично эти функции выполняют и карбонаты):
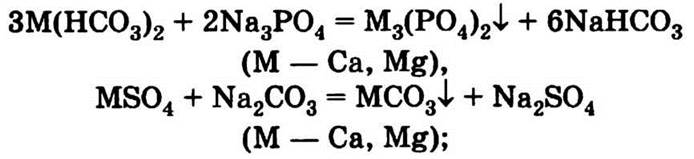
• карбонаты и силикаты устанавливают кислотно-щелочной баланс жидкости (за счет их гидролиза в растворе поддерживается щелочная среда, необходимая для стирки);
• сульфат натрия обеспечивает сыпучесть порошка;
• отдушки придают приятный запах.
1.21. При обработке «Персолью» отбеливание происходит за счет окисления загрязнений пероксигруппой —О—О— и частично за счет кислорода, который образуется в процессе разложения всех пероксидных соединений:
![]()
Чтобы образующийся кислород не улетучивался из емкости, лучше ее закрыть.
1.22. В эти типы порошков добавляют ферменты, разрушающие белковые загрязнения. Эти добавки будут частично разрушать и молекулы кератина, из которого состоит верхний слой кожи. Чаще всего в порошки добавляют протеолитические ферменты, которые катализируют гидролиз белков и пептидов по пептидным связям. Поскольку в молекулах кератина присутствуют, кроме пептидных, и другие связи, полностью он разрушается только под действием кератолитических ферментов. Однако частичное его разрушение происходит и под влиянием протеолитических ферментов. Кроме того, нередко в состав порошков включают и ферменты, способствующие эмульгированию и расщеплению жиров, что приводит к обезжириванию кожи.
1.23. Сажа представляет собой чистый углерод, который является химически инертным при обычных условиях. Отбеливатели обесцвечивают загрязнения за счет их окисления, но окислить чистый углерод с помощью кислородсодержащих отбеливателей невозможно даже при кипячении. Поэтому лучше попробовать чисто физический, точнее механический, способ: несколько раз постирать полотенце в стиральной машине. Только таким путем можно удалить частицы углерода, адсорбированные волокнами ткани.
1.24. После высыхания ткани, смоченной раствором нашатырного спирта, на ней не остается пятен, так как NH3 постепенно улетучивается, т. е. обработка нашатырным спиртом (если им только осторожно протирать один слой ткани, не допуская глубокого промокания) в некоторой степени заменяет химчистку. Если же протирать воротник раствором соды, его надо затем тщательно смывать водой, иначе после высыхания останутся белые пятна, т. е. получается не сухая чистка, а стирка, в результате которой воротник может потерять форму.
1.25. Раствор соли замерзает при значительно более низких температурах, чем чистая вода, поэтому белье остается мягким.
1.26. Все объекты стирки являются полимерными материалами — природными (шерсть — белковые соединения, хлопок — целлюлоза) или синтетическими (например, полиэфирные волокна). В этих материалах частично сохраняются двойные связи, поэтому они могут вступать в химическое взаимодействие с загрязнителями, которые по своей химической природе относятся чаще всего к жирам. Загрязнители к тому же могут и окисляться кислородом воздуха. Длительное хранение загрязненной одежды или ее нагревание при глажении способствуют более глубокому протеканию этих реакций и более прочному связыванию загрязнений с тканью, в результате чего отстирать загрязнения значительно сложнее.