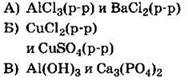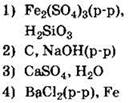Химия 9 класс - Основной государственный экзамен - Типовые тестовые задания А. С. Корощенко - 2018 год
РЕШЕНИЕ ЗАДАНИЙ ВАРИАНТА 3
Часть 1
1. На приведенном рисунке
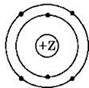
изображена модель атома
1) кремния
2) серы
3) кислорода
4) углерода
Решение. Для ответа на первое задание вспомним, что все электроны в атоме распределены по электронным слоям (или энергетическим уровням). Число таких слоев (уровней) равно номеру периода, в котором расположен химический элемент в Периодической системе элементов Д.И. Менделеева. Следовательно, если на атомной модели изображено 2 уровня, то этот элемент находится во 2-м периоде, и все электроны в его атомах располагаются на двух уровнях (слоях).
Число электронов в атоме равно его порядковому номеру. Следовательно, элемент с порядковым номером б — это углерод.
Ответ: 4.
2. Порядковый номер химического элемента в Периодической системе Д.И. Менделеева соответствует:
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего слоя
4) числу электронных слоев в атоме
Решение. Как известно, порядковый номер химического элемента в Периодической системе элементов Д.И. Менделеева совпадает с величиной положительного заряда атомных ядер (закон Г. Мозли). Однако такого варианта ответа среди предложенных нет. Для выбора правильного ответа вспомним тот факт, что атом в целом электронейтрален, т.е. число положительно заряженных протонов в ядре равно числу отрицательно заряженных электронов, вращающихся вокруг ядра. Таким образом, правильным является первый вариант ответа.
Ответ: 1.
3. Ионной связью образовано каждое из двух веществ
1) хлорид бария и нитрид лития
2) фосфин и аммиак
3) оксид углерода(II) и оксид бария
4) оксид углерода(IV) и оксид фосфора(V)
Решение. Ионная химическая связь реализуется в бинарных соединениях, образованных наиболее электроположительными (активными) металлами и наиболее электроотрицательными неметаллами, например в соединениях типа NaCl, CaF2, КН, СаО. Кроме того, ионная связь реализуется в сложных солях и кристаллических щёлочах, имеющих ионную кристаллическую решетку, например в КОН, Na2SO4, KNO3. Так, в последнем случае кристаллическая решетка состоит из ионов К+ и NO3-. Среди перечисленных в задании соединений только хлорид бария и нитрид лития имеют в своем составе ион металла и ион неметалла (Ва+2Сl2- и Li3+N-3).
Ответ: 1.
4. Азот проявляет одинаковую степень окисления в каждом из двух веществ, формулы которых:
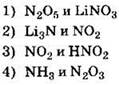
Решение. В первую очередь необходимо вспомнить определение понятия “степень окисления”. Степень окисления — это условный заряд на атоме в молекуле или кристалле. В отличие от валентности степень окисления может быть положительной, отрицательной или равной нулю. Степени окисления в простых ионных соединениях совпадают с зарядами ионов.
Хотя степень окисления и валентность — разные понятия, но при ее определении следует иметь в виду, что если валентность кальция в оксиде кальция равна II, то степень окисления кальция равна +2.
Как определить степени окисления в предложенных соединениях? Вещество N2O5образовано ковалентной полярной связью. Общая электронная пара в этой молекуле смещена к наиболее электроотрицательному атому — кислороду. Следовательно, кислород в этом соединении имеет степень окисления -2, а азот +5. Определим степени окисления элементов в соединении LiNO3, используя правило: в соединении их трех элементов только кислород имеет отрицательную степень окисления, а сумма степеней окисления всех атомов в молекуле равна нулю.
Li+1N+5O3-2. Определив степени окисления элементов в оставшихся формулах, получаем ответ.
Ответ: 1.
5. К кислотным оксидам относится каждое из двух веществ:
![]()
Решение. Как Вам известно, все оксиды делят на две группы — оксиды солеобразующие и несолеобразующие (или безразличные). Солеобразующие оксиды, в свою очередь, делят на кислотные, основные и амфотерные:
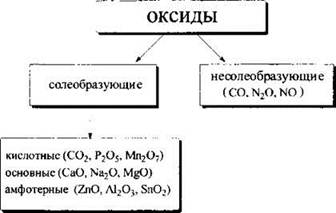
Проанализируем предложенные варианты ответов. Оксид углерода(IV) относится к кислотным (ему соответствует угольная кислота):
![]()
Оксид кальция — типичный основный оксид, которому соответствует сильное основание — гидроксид кальция:
![]()
Таким образом, первый вариант ответа не подходит. Точно так же откажемся и от второго варианта ответа — если SO2 относится к кислотным оксидам, то СО — к безразличным. В четвертом варианте приводятся оксиды фосфора (кислотный) и алюминия (амфотерный). И только в третьем варианте оба оксида — и SO2 и Р2O5 — кислотные.
Ответ: 3.
6. Выпадение осадка голубого цвета является признаком реакции между веществами:
1) гидроксидом натрия и соляной кислотой
2) карбонатом калия и хлоридом кальция
3) сульфатом аммония и хлоридом бария
4) нитратом меди(II) и гидроксидом бария
Решение. Вспомним условия протекания реакций обмена, которые идут до конца (являются практически необратимыми). К ним относятся: 1) образование осадка; 2) выделение газа; 3) образование малодиссоциирующего вещества.
Все приведенные ответы являются реакциями обмена:
1) NaOH + НСl — NaCl + Н2O, образуется малодиссоциирующее вещество — вода:
ОН- + H+ = Н2O
2) К2СO3 + СаСl2 = 2КСl + СаСO3, образуется осадок белого цвета — карбонат кальция:
СO32- + Са2+ = СаСO3
3) (NH4)2SO4 + ВаСl2 = 2NH4Cl + BaSO4, образуется осадок белого цвета — сульфат бария:
S042-+ Ва2+ = BaSO4 (качественная реакция на сульфат-ион SO42-).
4) CU(NO3)2+ Ва(ОН)2 = Ba(NO3)2+ Cu(OH)2— образуется осадок голубого цвета — гидроксид меди(II).
Сu2+ + 2OН- = Сu(ОН)2.
(для ионов меди Сu2+ характерен голубой цвет)
Ответ: 4.
7. Хлорид-ионы образуются при электролитической диссоциации
1) КСlO4
2) КСlO3
3) СН3Сl
4) КСl
Решение. Все 4 предложенных в ответе вещества содержат в своем составе хлор. Как же выбрать правильный ответ? Хлорид-ионы образуются только при диссоциации соляной кислоты и ее солей — хлоридов. Первая соль в ответе — перхлорат калия. Вторая соль — хлорат калия. И перхлорат, и хлорат калия диссоциируют в водном растворе с образованием иона калия и аниона кислотного остатка:
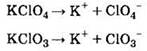
Как видно, хлорид-ионы не образуются при диссоциации этих солей.
Хлористый метил (или хлорметан), являясь органическим веществом (хлорпроизводным углеводородов), вообще не относится к электролитам и не диссоциирует. Оставшаяся соль — хлорид калия — действительно диссоциирует в растворе с образованием хлорид-иона:
![]()
Ответ: 4.
8. Взаимодействию соляной кислоты и едкого натра отвечает краткое ионное уравнение
![]()
Решение. Прежде всего запишем молекулярное уравнение взаимодействия соляной кислоты и едкого натра:
![]()
Исходные вещества (НСl и NaOH), а также один из продуктов реакции (NaCl) относятся к сильным электролитам и в воде полностью распадаются на ионы. Вода — электролит очень слабый.
Вспомним теперь правила составления уравнений реакций в ионном виде:
Правила составления уравнений реакций в ионном виде
1. Формулы всех веществ, относящихся к сильным электролитам, записываем в полностью ионизованном виде (т.е. в виде набора ионов).
2. Формулы веществ-неэлектролитов записываем в молекулярном виде.
3. Формулы веществ газообразных, или не растворимых в воде, также записываем в молекулярном виде.
В соответствии с этими правилами и проведенным выше анализом составим уравнение реакции взаимодействия соляной кислоты и едкого натра в ионном виде:
![]()
Исключив из уравнения одинаковые ионы (Сl-, Na+), получим краткое ионное уравнение данной реакции:
![]()
Ответ: 2.
9. Алюминий образует сульфат алюминия при взаимодействии с
1) серой
2) серной кислотой
3) сернистой кислотой
4) сероводородом
Решение. Проанализируем реакции, указанные в условии, и вспомним также, что соли сероводородной кислоты H2S называются сульфидами, серной кислоты H2SO4 — сульфатами и сернистой кислоты — сульфитами. Алюминий при взаимодействии с серой образует сульфид:
![]()
Взаимодействие с серной кислотой приводит к образованию сульфата:
![]()
Таким образом, сульфат образуется в ходе второй реакции. Проверка двух оставшихся вариантов утверждает нас в мысли, что правильным является второй ответ.
Ответ: 2.
10. Оксид железа(II) взаимодействует с раствором
1) аммиака
2) бромоводорода
3) карбоната калия
4) хлорида натрия
Решение. Оксид железа(II), являясь основным оксидом, должен взаимодействовать с веществами кислотной природы. В списке предложенных вариантов ответов только бромоводород удовлетворяет этому условию (его водный раствор называется бромоводородной кислотой). Вот как протекает реакция между этими веществами:
![]()
Ответ: 2.
11. И с серебром, и с оксидом меди(II) будет реагировать
1) соляная кислота
2) фосфорная кислота
3) азотная кислота
4) угольная кислота
Решение. Проанализируем все предложенные варианты ответа. Соляная кислота НСl, несомненно, будет реагировать с оксидом меди(II), однако реакция ее с серебром невозможна (серебро находится существенно правее водорода в ряду напряжений металлов). Аналогично, и фосфорная кислота Н3РO4 не может растворить серебро, хотя оксид меди(II) растворяется в ней. Угольная кислота настолько слаба, что даже ее взаимодействие с СuО кажется сомнительным. Остается третий вариант ответа — азотная кислота, у которой ярко выражены окислительные свойства, будет реагировать и с серебром, и с оксидом меди(II):
![]()
Ответ: 3.
12. Хлорид железа(II) в водном растворе может реагировать с
1) K2S
2) СO2
3) SiO2
4) Сu
Решение. Очевидно, что соль хлорида железа(II) FeCl2 не может взаимодействовать с такими веществами, как СO2, SiO2, так как соли не реагируют с оксидами. Медь не может вытеснять железо из его соли, так как является менее активной, чем железо (см. ряд напряжений металлов). И только с сульфидом калия возможно взаимодействие:
![]()
Ответ: 1.
13. Верны ли следующие суждения об обращении с растворами щёлочей?
А. При попадании раствора щёлочи на кожу рук его надо смыть водой, а затем обработать раствором борной кислоты.
Б. При попадании раствора щёлочи на кожу рук его надо смыть раствором соды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Решение. При ответе на этот вопрос следует помнить правила техники безопасности и обращения с веществами при работе в кабинете химии, а также правила оказания первой медицинской помощи. В соответствии с этими правилами в случае попадания на кожу щёлочи следует смыть ее большим количеством воды, а затем, по возможности, нейтрализовать остаток едкого вещества раствором слабой борной кислоты. Таким образом, ответ А следует признать правильным. Ответ Б неверный — сода сама относится к щёлочным агентам и ее применение в данной ситуации бессмысленно.
Ответ: 1.
14. В уравнении окислительно-восстановительной реакции
![]()
коэффициент перед формулой восстановителя равен:
1) 1
2) 2
3) 3
4) 4
Решение. Известно, что восстановителями являются нейтральные атомы, ионы металлов и неметаллов, молекулы, содержащие атомы элементов в низшей или промежуточной степени окисления. В химических реакциях восстановитель отдает электроны и повышает степень окисления. Определим степени окисления всех элементов в веществах, участвующих в реакции:
![]()
Определим восстановитель: Аl0 — алюминий (его атомы отдают электроны).
Расставим коэффициенты в уравнении реакции и запишем правильный ответ:
![]()
Ответ: 2.
15. Массовая доля азота в нитрате алюминия равна
1) 14,0%
2) 19,7%
3) 6,6%
4) 21,3%
Решение. Запишем химическую формулу нитрата алюминия: Al(NO3)3. Массовой долей элемента в соединении называют отношение массы, приходящейся на данный элемент, к массе всего взятого вещества. Применительно к расчетным задачам массовая доля элемента равна отношению атомной массы данного элемента (с учетом числа его атомов в молекуле) к молекулярной массе соединения:
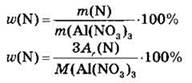
Подставим сюда взятые из Периодической системы Д.И. Менделеева атомные массы элементов и получим:
![]()
Ответ: 2.
16. Общим для фосфора и серы является:
1) наличие трех электронных слоев в их атомах
2) значение их электроотрицательности меньше, чем у хлора
3) образование ими водородных соединений с общей формулой ЭН2
4) образование ими простых веществ в виде двухатомных молекул
5) одинаковые значения степени окисления в кислородных соединениях.
Решение. Ответ на это задание требует установления общего в строении и свойствах фосфора и серы. С этой целью необходимо дать характеристику этих элементов по их положению в Периодической системе Д.И. Менделеева.
Сера и фосфор находятся в третьем периоде, значит, в их атомах имеется три электронных слоя.
Сравнение положения фосфора и серы с положением хлора, который также находится в третьем периоде, но расположен правее от Р и S, свидетельствует о том, что неметаллические свойства у хлора, принадлежащего к группе галогенов, выражены сильнее, чем у фосфора и серы. Это значит, что более электроотрицательным является хлор. Водородные соединения различаются составом: у фосфора РН3, а у серы — H2S. В кислородных соединениях их степень окисления также неодинакова: в высших оксидах Р2O5 и SO3 соответственно +5 и +6, как, например, и в кислотах фосфорной ![]() серной
серной ![]() сернистой
сернистой ![]()
Анализируя эту характеристику, получаем правильный ответ.
Ответ: 12.
17. С уксусной кислотой взаимодействуют вещества, формулы которых
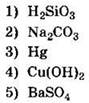
Решение. Как известно, свойства карбоновых кислот обусловлены прежде всего протонизированным атомом водорода. Растворимые кислоты изменяют окраску индикатора, имеют кислый вкус, проводят электрический ток, т.е. диссоциируют с образованием протона. Диссоциация уксусной кислоты происходит согласно уравнению:
![]()
Однако уксусная кислота является слабым электролитом, атомы водорода карбоксильной группы могут замещаться атомами только активных металлов.
Подобно неорганическим кислотам, уксусная кислота вступает в реакции с оксидами металлов, гидроксидами, солями слабых кислот, например с карбонатами.
С этих позиций проанализируем предложенные ответы. Кремниевая кислота H2SiO3, являясь нерастворимой кислотой, так же как и нерастворимая соль сильной серной кислоты сульфат бария BaSO4, не могут реагировать с уксусной кислотой. Не вступает во взаимодействие с ней и металл ртуть Hg, который в электрохимическом ряду напряжений стоит после водорода, а значит, не может вытеснить водород из кислоты.
Ответ: 24.
18. Установите соответствие между веществами и реактивом, щью которого можно различить эти вещества. К каждому ту первого столбца подберите соответствующий элемент из столбца.
|
ВЕЩЕСТВА
|
РЕАКТИВ |
||||
|
1) AgNO3(p-p) 2) фенолфталеин 3) КСl 4) NaOH(p-p) |
|||||
|
А |
Б |
В |
|||
Решение.
A) Обе соли являются хлоридами. Следовательно, различить их можно, только используя различия в свойствах катионов. Различие состоит в том, что гидроксид алюминия нерастворим в воде (в отличие от гидроксида бария). Поэтому, прилив к растворам гидроксид натрия, заметим протекание реакции только в пробирке с солью алюминия:
![]()
Б) Обе соли содержат один и тот же катион, но различные анионы. Качественной реакцией на хлорид-ионы является взаимодействие их с ионами серебра с образованием белого творожистого осадка:
![]()
B) Оба вещества нерастворимы в воде. Но гидроксид алюминия, будучи амфотерным, взаимодействует с щёлочами. Следовательно, он будет расворяться в растворе щёлочи:
![]()
Ответ: 414.
19. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
|
НАЗВАНИЕ ВЕЩЕСТВА А) оксид углерода(IV) Б) гидроксид калия В) сульфат меди(II) |
РЕАГЕНТЫ
|
||||
|
А |
Б |
В |
|||
Решение. В данном случае перед Вами задание на соответствие: каждой позиции из левого столбца надо подобрать соответствующую позицию из правого столбца. Слева записаны названия веществ. Справа записаны формулы реагентов, с которыми они могут взаимодействовать.
Под буквой А дан оксид углерода(IV) — это типичный кислотный оксид. Все кислотные оксиды реагируют с основаниями (щёлочами), образуя соль и воду. Кроме того, у оксида углерода(1У) есть особое свойство: он может восстанавливаться активными металлами, водородом, углеродом.
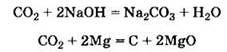
Следовательно, позиции А соответствуют реагенты, указанные справа под цифрой 2.
Под буквой Б приведен гидроксид калия КОН — типичное растворимое основание (щёлочь), которое вступает во взаимодействие с кислотами, кислотными оксидами, солями, растворимыми в воде. Реакция между основанием и кислотой Вам хорошо знакома. Это реакция нейтрализации, в ходе которой образуется соль — силикат калия и выделяется вода:
![]()
В реакции с солью образуется нерастворимый осадок: Fe(OH)3— гидроксид железа(III) и растворимая соль сульфат калия K2SO4. Это реакция обмена между щёлочью и растворимой солью.
![]()
Эти вещества указаны справа под цифрой 1.
Под буквой В слева приведена соль CuSO4 — сульфат меди(II). Соли могут реагировать между собой, при условии, если они обе растворяются. Из оставшихся формул солей, приведенных справа, растворимой солью является ВаСl2 — хлорид бария, взаимодействие с которым является качественной реакцией на серную кислоту и ее соли; выпадает осадок сульфата бария.
![]()
Кроме того, железо как более активный металл может вытеснять менее активный металл медь из растворов ее солей:
![]()
Следовательно, ПОЗИЦИИ В отвечают реагенты, указанные справа под цифрой 4.
Заполненная таблица будет выглядеть так:
|
А |
Б |
В |
|
2 |
1 |
4 |
Ответ: 214.
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
![]()
Укажите окислитель и восстановитель.
Решение.
1) Составлен электронный баланс.
![]()
2) Расставлены коэффициенты в уравнении реакции:
![]()
3) Указано, что иод в степени окисления -1 является восстановителем, а сера в степени окисления +6 — окислителем.
21. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 17,4 г раствора нитрата бария с массовой долей последнего 15%.
Решение.
1) Составлено уравнение реакции:
![]()
2) Рассчитана масса и количество вещества нитрата бария в растворе:
![]()
3) Определена масса вещества, выпавшего в осадок
по уравнению реакции ![]()
![]()
Ответ: m(ВаСO3) = 1,97 г.
22. Даны вещества: Zn, НСl(разб), Fe, К3РO4, NaOH, СаСO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии ортофосфат кальция. Опишите признаки проводимых реакций. Для первой реакции напишите сокращенное ионное уравнение.
Решение.
Составлены два уравнения реакции:
![]()
Описаны признаки протекания реакций:
3) для первой реакции: выделение бесцветного газа;
4) для второй реакции: образование белого осадка.
Составлено сокращенное ионное уравнение первой реакции:
![]()