Химия ОГЭ - Основной государственный экзамен - Комплекс материалов для подготовки учащихся - Д.Ю. Добротин - 2018 год
ВАРИАНТ 1 - ПРИМЕРНЫЕ ВАРИАНТЫ ОГЭ 2017
Часть 1
При выполнении заданий 1—15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа.
1. Схема строения электронных оболочек

соответствует атому химического элемента
1) 2-го периода IIА группы
2) 2-го периода IIIА группы
3) 3-го периода IIIА группы
4) 3-го периода IIА группы
Ответ: [ ]
2. В ряду химических элементов Rb → К → Na
1) усиливаются металлические свойства
2) ослабевают восстановительные свойства
3) уменьшается электроотрицательность атомов
4) возрастает высшая степень окисления в оксидах
Ответ: [ ]
3. Какой вид химической связи имеет белый фосфор?
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
Ответ: [ ]
4. Высшую степень окисления хлор имеет в соединении

Ответ: [ ]
5. Вещества, формулы которых СаО и КОН, являются соответственно
1) основным оксидом и щёлочью
2) кислотным оксидом и щёлочью
3) амфотерным оксидом и кислотой
4) основным оксидом и амфотерным гидроксидом
Ответ: [ ]
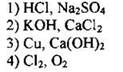
6. Какое уравнение соответствует окислительно-восстановительной реакции?
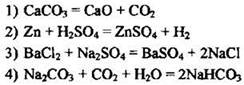
Ответ: [ ]
7. Один моль катионов и три моля анионов образуются при электролитической диссоциации в растворе 1 моль

Ответ: [ ]
8. Выделением газа сопровождается взаимодействие ионов
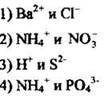
Ответ: [ ]
9. Азот реагирует с
1) водой
2) соляной кислотой
3) кислородом
4) фосфором
Ответ: [ ]
10. Оксид алюминия реагирует с

Ответ: [ ]
11. В реакцию с раствором соляной кислоты вступает
1) фосфат калия
2) нитрат серебра
3) углерод
4) оксид серы(IV)
Ответ: [ ]
12. Среди солей, формулы которых: CuSO4, (NH4)2S, KNO3, Na3РО4, с раствором хлорида железа(III) реагируют
1) только CUSO4
2) CuSO4 и (NH4)2S
3) (NH4)2S И Na3PO4
4) все приведённые соли
Ответ: [ ]
13. Верны ли суждения о правилах обращения с препаратами бытовой химии?
А. Перед использованием застывшую масляную краску рекомендуется подогреть на открытом огне.
Б. При использовании органических растворителей во время ремонта окна в помещении должны быть плотно закрыты.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответ: [ ]
14. Сера является окислителем в реакции
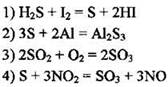
Ответ: [ ]
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу нитрата железа(III)?

Ответ: [ ]
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
16. Общим для натрия и алюминия является
1) наличие 12 протонов в ядрах их атомов
2) нахождение валентных электронов в третьем электронном слое
3) образование простых веществ-металлов
4) существование в природе в виде двухатомных молекул
5) образование ими высших оксидов с общей формулой Э2О
Ответ: ![]()
17. Для глицерина верны следующие утверждения:
1) молекула содержит 3 атома углерода
2) все связи в молекуле двойные
3) газообразное вещество (н.у.)
4) реагирует с натрием
5) нерастворим в воде
Ответ: ![]()
При выполнении заданий 18, 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
|
ВЕЩЕСТВА
|
РЕАКТИВ
|
|
Выбранные цифры запишите под соответствующими буквами таблицы.
Ответ:
|
А |
Б |
В |
19. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
|
ФОРМУЛА ВЕЩЕСТВА
|
РЕАГЕНТЫ |
|
Ответ:
|
А |
Б |
В |
Часть 2
Для ответов на задания 20-22 используйте отдельный лист. Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый ответ к нему. Ответы записывайте чётко и разборчиво.
20. Используя метод электронного баланса, составьте уравнение реакции
![]()
Определите окислитель и восстановитель.
21. В результате взаимодействия растворов нитрата серебра и хлорида калия, взятого в избытке, выпал осадок массой 2,87 г. Вычислите массу исходного раствора нитрата серебра с массовой долей 17%, взятого для реакции.
22. Для проведения эксперимента предложены следующие реактивы: растворы NaCl, NaOH, H2SO4, BaCl2, Fe. Используя необходимые вещества только из этого списка, получите в результате двух последовательных реакций хлорид железа(II).
Напишите уравнения реакций. Опишите признаки проводимых реакций. Для второй реакции напишите сокращённое ионное уравнение.