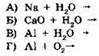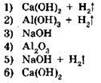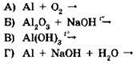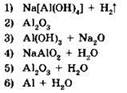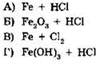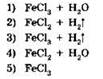Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Химические свойства простых веществ - металлов: щелочных и щелочноземельных металлов, алюминия, железа - Химические свойства простых веществ
Щелочные металлы
К щелочным металлам относят s-элементы главной подгруппы I группы: литий, натрий, калий, рубидий, цезий и франций. Франций — искусственно полученный радиоактивный элемент, практически не содержащийся в природе. Получен он в количестве нескольких атомных ядер, свойства его не столько изучены, сколько теоретически предсказаны на основании Периодического закона. В дальнейшем о франции мы говорить не будем.
Электронные конфигурации атомов всех щелочных металлов однотипны — поверх электронной конфигурации инертного газа имеется один неспаренный электрон:
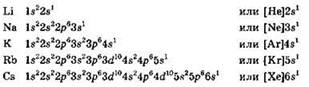
Наличие одного валентного (внешнего) электрона объясняет существование единственной степени окисления щелочных металлов в соединениях, равной +1.
С увеличением радиуса атома от Li к Fr энергия ионизации атомов уменьшается, следовательно, наблюдаемая химическая активность металлов в этом ряду увеличивается. Щелочные металлы среди всех металлов обладают наибольшей химической активностью, являясь очень сильными восстановителями. Так, они вытесняют водород не только из кислот, но и из воды и даже из спиртов:
![]()
Литий взаимодействует с водой относительно спокойно, натрий — бурно, калий воспламеняется в контакте с водой, рубидий и цезий реагируют взрывообразно.
Все щелочные металлы довольно легко окисляются кислородом воздуха (поэтому хранят их или в керосине, или под слоем минерального масла, или в вакуумированных ампулах). Продукты взаимодействия щелочных металлов с кислородом различны. Если литий окисляется до оксида, то натрий образует в основном пероксид, а калий — надпероксид:
![]()
Пероксиды и надпероксиды щелочных металлов являются сильнейшими окислителями. Щелочные металлы реагируют практически со всеми неметаллами (исключая инертные газы). Вот примеры таких реакций:
с водородом 2Na + Н2 = 2NaH (гидрид натрия)
с серой 2Li + S = Li2S (сульфид лития)
с азотом 6Li + 3N2 = 2Li3N (нитрид лития)
с хлором 2К + Сl2 = 2КСl (хлорид калия).
Важнейшими соединениями щелочных металлов являются:
NaCl — хлорид натрия, пищевая соль, минерал галит,
Na2SO4 ∙ 10Н2O — декагидрат сульфата натрия, минерал мирабилит или глауберова соль,
Na2CO3— карбонат натрия, кальцинированная сода,
Na2CO3 ∙ 10Н2O — декагидрат карбоната натрия, кристаллическая (стиральная) сода,
NaHCO3 — гидрокарбонат натрия, пищевая сода,
NaOH — гидроксид натрия, едкий натр, каустик,
Na2O2 — пероксид натрия,
КСl — хлорид калия,
КОН — гидроксид калия, едкое кали,
К2СO3 — карбонат калия, поташ,
KNO3 — нитрат калия, калиевая селитра.
Качественной реакцией на ионы щелочных металлов является окрашивание пламени: ионы лития окрашивают пламя в карминово-красный цвет, ионы натрия — в жёлтый, ионы калия — в фиолетовый.
Получают щелочные металлы электролизом расплавов хлоридов или гидроксидов, или вытеснением другими активными металлами:
![]()
Протекание последней реакции возможно из-за большей летучести калия по сравнению с натрием.
Щёлочноземельные металлы
Главную подгруппу II группы Периодической системы образуют s-элементы бериллий, магний, кальций, стронций, барий и радий. Элементы кальций, стронций и барий получили историческое название “щелочноземельные металлы”. Иногда это название не совсем оправданно переносят на все элементы IIА группы.
Электронные конфигурации атомов всех элементов IIА группы однотипны — поверх электронной конфигурации инертного газа имеются два внешних электрона:
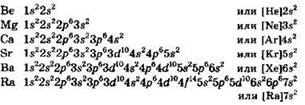
Наличие двух валентных (внешних) электронов объясняет существование единственной степени окисления этих элементов в соединениях, равной +2.
Поскольку заряд ядра в атомах этих элементов на единицу больше, чем в атомах щелочных металлов, то валентные электроны сильнее притягиваются к ядру, что приводит к некоторому увеличению энергии ионизации при переходе от щелочного металла к щелочноземельному. Результатом этого является понижение химической активности при переходе от щелочных металлов к щелочноземельным.
С увеличением радиуса атома от Be к Ra энергия ионизации атомов уменьшается, следовательно, химическая активность металлов по подгруппе увеличивается. Наименее активен бериллий. Свойства бериллия сильно отличаются от свойств остальных элементов IIА группы, что связано с меньшим атомным радиусом его и более высоким значением энергии ионизации. Химические свойства бериллия гораздо ближе к свойствам алюминия, чем магния и кальция (диагональное сходство). Так, оксид и гидроксид бериллия проявляют амфотерные свойства, в отличие от оксидов и гидроксидов щелочноземельных металлов.
На воздухе бериллий и магний вполне устойчивы, т.к. покрыты прочной оксидной плёнкой. При высокой температуре эти металлы взаимодействуют с кислородом, окисляясь до оксидов. Кальций и другие щелочноземельные металлы, будучи более активными, окисляются кислородом уже на холоду:
2Са + O2 = 2СаО
При нагревании все металлы ПА группы взаимодействуют с галогенами, серой, азотом, фосфором:
![]()
С водой бериллий не реагирует даже при температуре красного каления, в то время как магний взаимодействует с горячей водой, а кальций и его аналоги — даже с холодной:
![]()
Все металлы IIА группы легко растворяются в кислотах, образуя соли:
![]()
Бериллий в силу амфотерности его оксида и гидроксида может взаимодействовать и с растворами щелочей с образованием гидроксобериллатов:
![]()
В ряду оксидов ВеО — MgO — СаО — SrO — ВаО — RaO основность возрастает, такая же тенденция действует и в ряду гидроксидов. Если ВеО и Ве(ОН)2 проявляют амфотерные свойства, то остальные оксиды и гидроксиды — исключительно основные. Гидроксиды кальция, стронция, бария и радия являются сильными основаниями и относятся к щелочам.
Важнейшими соединениями элементов НА группы являются:
СаО — оксид кальция, негашёная известь,
Са(ОН)2 — гидроксид кальция, гашёная известь,
CaSO4 ∙ 2Н2O — дигидрат сульфата кальция, гипс.
Алюминий
Алюминий — элемент IIIA группы, электронная конфигурация его атома 1s22s22p63s23p1. Таким образом, на внешнем уровне атом алюминия содержит три валентных электрона. За счёт этих электронов типичная степень окисления алюминия +3.
Химическая активность алюминия довольно высока, в ряду активности металлов он расположен непосредственно за щелочноземельными металлами и магнием. Проявляя сильные восстановительные свойства, алюминий реагирует с неметаллами, кислотами, солями, а также растворами щелочей.
Кислородом алюминий окисляется с образованием оксида:
![]()
Из-за высокой теплоты образования Аl2O3 металлический алюминий способен восстанавливать многие оксиды до свободных металлов:
![]()
Эта реакция (реакция алюминотермии) используется в промышленности при получении бария, стронция, ванадия, хрома, вольфрама и др.
Галогены взаимодействуют с алюминием с образованием галогенидов, например:
![]()
Алюминий взаимодействует также с серой, фосфором, азотом, углеродом:
![]()
Кислоты взаимодействуют с алюминием с образованием солей:
![]()
В то же время концентрированные серная и азотная кислоты без нагревания на алюминий не действуют (пассивация металла).
Алюминий может растворяться в растворах щелочей, образуя гидроксоалюминаты:
![]()
При удалении с алюминия прочной оксидной плёнки (например, при амальгамировании) активность алюминия повышается настолько, что возможно его взаимодействие с водой:
![]()
Наиболее важное соединение алюминия — его оксид. И оксид, и гидроксид алюминия, проявляя амфотерные свойства, взаимодействуют как с кислотами, так и с щелочами:
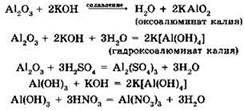
Оксид алюминия может взаимодействовать при высокой температуре и с некоторыми солями, например:
![]()
В первой реакции, взаимодействуя с кислой солью, оксид алюминия проявляет основные свойства, а во второй — кислотные.
Железо
Железо — представитель переходных металлов — находится в побочной подгруппе VIII группы Периодической системы элементов Д.И. Менделеева. Электронная конфигурация его атома
1s22s22p63s23p63d64s2.
Исходя из электронной конфигурации, можно сделать вывод, что для железа, за счёт отдачи внешних 4s2-электронов, должны существовать производные в степени окисления +2. Это действительно так. Однако вспомним, что для переходных элементов в образовании химических связей могут принимать участие не только внешние, но и предвнешние электроны с 3d-подуровня. В результате этого у железа есть и другая степень окисления, а именно +3. Получены также неустойчивые производные в степени окисления +6, например K2FeO4 — феррат(VI) калия.
С химической точки зрения железо — металл средней активности. Кислородом железо окисляется, в зависимости от температуры, с образованием окисдов FeO, Fe3O4и Fe2O3:
3Fe + 2O2 = Fe3O4
Оксид состава Fe304можно рассматривать как двойной оксид, содержащий железо в двух степенях окисления: FeO ∙ Fe2O3, или как FeII(FeIIIO2)2. В природе Fe3O4встречается в виде минерала магнетита (магнитного железняка).
При нагревании железо реагирует с такими неметаллами, как сера, углерод, азот, фосфор, галогены, например:
3Fe + С = Fe3C (карбид железа, цементит)
4Fe + N2 = 2Fe2N (нитрид железа)
Из галогенов фтор, хлор и бром окисляют железо до степени окисления +3, в то время как иод (слабый окислитель) — до степени окисления +2:
![]()
С водой железо реагирует при высоких температурах, образуя железную окалину и водород:
![]()
В присутствии кислорода железо медленно взаимодействует с водой, окисляясь до гидроксида железа(III) — процесс ржавления железа:
![]()
Железо легко взаимодействует с кислотами, образуя соли в степени окисления +2 (с кислотами-неокислителями) или +3 (с кислотами-окислителями), например:
![]()
Концентрированными азотной и серной кислотами железо на холоду пассивируется, однако при нагревании возможны и эти реакции.
С водными растворами щелочей железо практически не реагирует, однако при длительном кипячении порошка железа с концентрированным раствором щёлочи без доступа воздуха возможна реакция:
![]()
Железо может взаимодействовать и с солями, вытесняя из них менее активные металлы:
![]()
Железо образует два гидроксида*: Fe(OH)2и Fe(OH)3. С точки зрения кислотно-основных свойств при переходе от Fe(OH)2к Fe(OH)3основный характер гидроксидов уменьшается. Если гидроксид железа(II) относится к основаниям, то гидроксид железа(III) — к амфотерным гидроксидам. Так, Fe(OH)3может растворяться и в кислотах, и в концентрированных растворах щелочей. Однако последняя реакция протекает в малой степени, свидетельствуя о преобладании основных свойств Fe(OH)3над кислотными.
Соединения железа(II) легко окисляются до соединений железа(III), особенно в щелочной среде:
![]()
Наоборот, сильными восстановителями железо(III) может быть восстановлено до железа(II):
![]()
Качественными реакциями на соли железа могут быть следующие:
на ионы Fe2+:
![]()
на ионы Fe3+:
![]()
В ходе первой реакции ионы Fe2+ реагируют с гексацианоферратом(III) калия (“красной кровяной солью”) с образованием тёмно-синего осадка “турнбуллевой сини”. В ходе второй реакции ионы Fe3+ образуют с гексацианоферратом(II) калия (“жёлтой кровяной солью”) тёмно-синий осадок “берлинской лазури”. Кроме этого, ионы железа(III) можно обнаружить по появлению кроваво- красной окраски при взаимодействии с роданид-ионами:
![]()
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. В ряду элементов
![]()
увеличивается
1) число энергетических уровней
2) атомный радиус
3) число валентных электронов
4) электроотрицательность
2. В порядке усиления металлических свойств вещества расположены в ряду
1) Na, Mg, Al
2) Mg, Ca, Sr
3) Rb, Ca, Na
4) Ca, Mg, Be
3. В каком ряду простые вещества расположены в порядке уменьшения металлических свойств?
1) Ва, Sr, Са
2) Na, К, Rb
3) Mg, Са, Sr
4) Al, Mg, Na
4. Металлические свойства усиливаются в ряду веществ:
1) натрий — магний — алюминий
2) рубидий — калий — натрий
3) кальций — стронций — барий
4) кальций — магний — бериллий
5. Верны ли следующие суждения о щелочных металлах?
А. Для щелочных металлов характерна степень окисления +1.
Б. С неметаллами они образуют соединения, как правило, с ионной связью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
6. Верны ли следующие суждения о железе?
А. Железо относится к d-элементам.
Б. Для железа характерна степень окисления +8.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Верны ли следующие суждения о магнии?
А. Во всех соединениях магний проявляет степень окисления +2.
Б. Гидроксид магния проявляет основные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8. Какой из металлов не вытесняет водород из разбавленной серной кислоты?
1) железо
2) натрий
3) медь
4) магний
9. Щелочь образуется при взаимодействии с водой
1) магния
2) алюминия
3) бария
4) железа
10. С водой не взаимодействует
1) бериллий
2) магний
3) железо
4) натрий
11. Натрий реагирует с каждым из двух веществ:
1) вода и метан
2) кислород и хлор
3) аргон и водород
4) гелий и хлороводород
12. Алюминий реагирует с каждым из двух веществ:
1) оксид железа(III) и водород
2) вода и сульфат натрия
3) гидроксид натрия и соляная кислота
4) кислород и гидроксид цинка(II)
13. Какой из металлов можно использовать для вытеснения меди из раствора сульфата меди(II)?
1) серебро.
2) цинк
3) платину.
4) цезий
14. Между какими веществами возможна химическая реакция?
1) Ag и Н2O
2) Fe и Na3PO4
3) Сu и MgCl2
4) Zn и FeBr2
15. При обычных условиях практически осуществима реакция между железом и
1) серой (кр.)
2) серной кислотой (конц.)
3) нитратом магния (р-р)
4) хлоридом меди(II) (р-р)
16. Алюминий образует сульфат алюминия при взаимодействии с
1) серой
2) серной кислотой
3) сернистой кислотой
4) сероводородом
17. Натрий образует нитрат натрия при взаимодействии с
1) азотом
2) аммиаком
3) азотной кислотой
4) оксидом азота(I)
18. Магний легко растворяется в
1) дистиллированной воде
2) аммиачной воде
3) растворе НСl
4) растворе Na2CO3
19. С образованием соединения, содержащего ионы Н-, водород реагирует с
1) хлором
2) серой
3) натрием
4) кислородом
При выполнении заданий выберите правильные ответы. Установите соответствие.
20. Железо может взаимодействовать с растворами:
1) сульфата натрия
2) сульфата меди(II)
3) хлорида кальция
4) серной кислоты
5) гидроксида кальция
Ответ: ____ .
21. Установите соответствие между металлом и электронным строением его атома.
|
МЕТАЛЛ |
ЭЛЕКТРОННОЕ СТРОЕНИЕ |
|
A) Na Б) Са В) Аl Г) Fe |
1) 1s22s22p1 |
|
2) 1s22s22p63s23p64s2 |
|
|
3) 1s22s22p63s2 |
|
|
4) 1s22s22p63s23p1 |
|
|
5) 1s22s22p63s1 |
|
|
6) 1s22s22p63s23p63d64s2 |
|
А |
Б |
В |
Г |
22. Установите соответствие между исходными веществами и продуктами реакции.
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
|
|
|
А |
Б |
В |
Г |
23. Установите соответствие между формулами исходных веществ и продуктов реакции.
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
|
|
|
А |
Б |
В |
Г |
24. Установите соответствие между формулами исходных веществ и продуктов реакции.
|
ИСХОДНЫЕ ВЕЩЕСТВА |
ПРОДУКТЫ РЕАКЦИИ |
|
|
|
|
А |
Б |
В |
Г |
25. В ряду химических элементов Na — Mg — Al:
1) уменьшается заряд ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
Ответ: ____ .
* Существует ещё мета-гидроксид железа состава FeO(OH), известный как минерал гётит.