Химия - Новый полный справочник для подготовки к ОГЭ - 2018 год
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
Ядро атома. Нуклоны. Изотопы
Атом — мельчайшая частица химического элемента. В течение долгого времени атомы считались неделимыми, что и отражено в самом их названии (“атомос” по-гречески означает “неразрезаемый, неделимый”). Экспериментальные исследования, проведённые в конце XIX — начале XX века знаменитыми физиками В. Круксом, В.К. Рентгеном, А. Беккерелем, Дж. Томсоном, М. Кюри, П. Кюри, Э. Резерфордом и другими, с убедительностью доказали, что атом — сложная система, состоящая из более мелких частиц, первыми из которых были открыты электроны. В конце XIX в. было установлено, что некоторые вещества при сильном освещении испускают лучи, представлявшие собой поток отрицательно заряженных частиц, которые и были названы электронами (явление фотоэффекта). Позднее было установлено, что есть вещества, самопроизвольно испускающие не только электроны, но и другие частицы, причём не только при освещении, но и в темноте (явление радиоактивности).
По современным представлениям, в центре атома находится положительно заряженное атомное ядро, вокруг которого по сложным орбитам двигаются отрицательно заряженные электроны. Размеры ядра очень малы — ядро примерно в 100 000 раз меньше размеров самого атома. Практически вся масса атома сосредоточена в ядре, поскольку электроны имеют очень маленькую массу — они в 1837 раз легче атома водорода (самого лёгкого из атомов). Электрон — самая лёгкая из известных элементарных частиц, его масса всего 9,11 ∙ 10-31 кг. Поскольку электрический заряд электрона (равный 1,60 ∙ 10-19 Кл) является наименьшим из всех известных зарядов, его называют элементарным зарядом. Так как все остальные заряды (отрицательные и положительные) кратны заряду электрона, их величину выражают в условных единицах, принимая абсолютный заряд электрона за единицу измерения. Условный заряд электрона при этом равен -1, катиона кальция +2, сульфат-иона -2 и т. д.
Ядро атома состоит из протонов и нейтронов. Протоны и нейтроны объединяют одним названием — нуклоны (“нуклеос” — по-гречески “ядро”). Протоны представляют собой положительно заряженные частицы с условным зарядом +1, нейтроны заряда не имеют. Следовательно, весь положительный заряд атомных ядер обусловлен присутствием в ядрах протонов. В целом атом электронейтрален, поскольку число протонов в ядре равно числу электронов в атоме. Общее число нуклонов в ядре (протонов и нейтронов) называют массовым числом атома: А = Z + N. Массовое число атома — величина всегда целая и близкая к значению его атомной массы (поскольку масса каждого нуклона, как это видно из таблицы 1, примерно равна 1 а.е.м.).
Таблица 1
Основные характеристики электронов и нуклонов
|
Частица |
Заряд, Кл |
Заряд, усл. ед. |
Массовое число |
Масса, кг |
Масса, а.е.м. |
|
Электрон ē |
-1,60 ∙ 10-19 |
-1 |
0 |
9,11 ∙ 10-31 |
5,5 ∙ 10-4 |
|
Протон р |
+1,60 ∙ 10-19 |
+1 |
1 |
1,67 ∙ 10-27 |
1,0073 |
|
Нейтрон n |
0 |
0 |
1 |
1,67 ∙ 10-27 |
1,0087 |
В соответствии с законом Г. Мозли (1913), заряд ядра численно равен порядковому номеру элемента в Периодической системе элементов Д.И. Менделеева. Другими словами:
![]()
Так, все атомы натрия имеют заряд ядра +11 (т. е. содержат 11 протонов в ядре), так как порядковый номер натрия в Периодической системе равен 11. Все атомы хлора имеют заряд ядра +17 (т. е. содержат 17 протонов в ядре), так как порядковый номер хлора равен 17. Все атомы урана имеют заряд ядра +92, так как порядковый номер урана равен 92.
В то же время число нейтронов в ядрах атомов одного и того же элемента может быть различно. Так, в природе есть три разновидности атомов водорода. Ядро любого из атомов водорода содержит один протон, но разное число нейтронов. В ядрах атомов самой лёгкой разновидности водорода нейтронов нет, ядра двух других разновидностей содержат либо один, либо два нейтрона. Следовательно, существуют три разновидности атомов водорода — с массовым числом 1, массовым числом 2 и массовым числом 3. Это условно записывают следующим образом:
![]()
Слева внизу от символа элемента обозначают его порядковый номер в Периодической системе (заряд ядра или число протонов в ядре). Слева вверху указывают массовое число (сумму протонов и нейтронов в ядре).
Следовательно, атомы одного и того же элемента могут различаться по массе. Разновидности атомов одного и того же элемента, различающиеся по массе, называются изотопами. Так, для водорода существует три изотопа: 1Н, 2Н и 3Н. Только для водорода каждый изотоп имеет своё название — протий, дейтерий и тритий соответственно. Изотопы остальных элементов называют, прибавляя к названию элемента, массовое число изотопа, например: 12С — изотоп углерода-12, 235U — изотоп урана-235 и т. д. Всего известно около 2000 различных изотопов, причём в природе существует чуть более 250 из них, остальные получены искусственным путём. Все изотопы одного химического элемента имеют одинаковые свойства.
Наличие изотопов — одна из причин* дробных значений атомных масс элементов, приведённых в Периодической системе. Так, хлор в природе представлен смесью двух изотопов: 35Сl (75% от числа всех атомов хлора) и 37Сl (25%). Атомная масса элемента рассчитывается с учётом распространённости отдельных изотопов в природе и для хлора составляет: Аr(Сl) = 35 ∙ 0,75 + 37 ∙ 0,25 ≈ 35,5.
Электронные оболочки
В соответствии с современными представлениями, электрон имеет двойственную природу, проявляя и свойства частицы, и свойства волны. Волна отличается от частицы тем, что её положение в пространстве в данный момент времени нельзя точно определить. В силу этого электрон может находиться в любой части околоядерного пространства, но вероятность его пребывания в разных частях этого пространства неодинакова. Состояние электрона в атоме характеризуют с помощью понятия атомной орбитали. Атомная орбиталь — это область пространства в атоме, в которой наиболее вероятно находится электрон**.
Каждая атомная орбиталь имеет определённую форму, орбитали разной симметрии обозначают буквами s, р, d и f.
s-Орбитали имеют форму сферы (шара), р-орбитали — форму объёмной восьмёрки, вытянутой вдоль соответствующей оси координат (рис. 1):
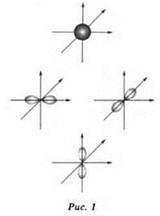
d- и f-oрбитали имеют более сложную форму (рис. 2).
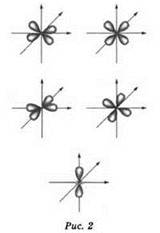
Атомные орбитали группируются, образуя энергетические уровни и подуровни. Энергетические уровни обозначают числом (n = 1, 2, 3, 4 и т. д.) или буквой (К, L, М, N и т. д.).
Электроны на ближайшем к ядру энергетическом уровне (n = 1) обладают наименьшей энергией. По мере увеличения номера уровня запас энергии электронов возрастает. Наибольшей энергией обладают электроны на внешнем энергетическом уровне: поскольку они наименее связаны с ядром, то именно они принимают участие в образовании химических связей.
В каждом атоме существует бесконечное множество энергетических уровней, однако заполняются электронами только некоторые из них. Это связано с определённой ёмкостью каждого уровня. Так, первый энергетический уровень максимально может вместить только 2 электрона. На втором уровне максимально может находиться 8 электронов. На третьем — 18, на четвёртом — 32. Другими словами, максимальное число электронов на любом энергетическом уровне равно 2n2, где n — номер уровня. Следует запомнить также, что число электронов на внешнем уровне не может превышать восьми. Ниже мы выясним, почему каждый энергетический уровень имеет определённую ёмкость.
Каждый энергетический уровень состоит из нескольких подуровней. Подуровень объединяет орбитали одного вида, поэтому говорят о s-подуровне, р-подуровне, d-подуровне и т. д. Число подуровней в энергетическом уровне равно номеру этого уровня. Так, первый уровень состоит только из одного подуровня (1s-подуровень), второй уровень — из двух подуровней (2s и 2р), третий — из трёх подуровней (3s, 3р и 3d) и т. д. Следует запомнить, что любой s-подуровень состоит из одной s-орбитали, р-подуровень — из трёх р-орбиталей, d-подуровень — из пяти d-орбиталей. Для данного энергетического уровня энергия s-подуровня наименьшая, а энергия f-подуровня — наибольшая:
![]()
Всё сказанное поясняет следующая схема расположения энергетических уровней и подуровней (рис. 3).
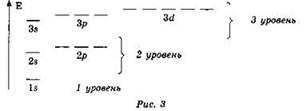
Итак, первый энергетический уровень состоит из 1 атомной орбитали, второй энергетический уровень включает 4 атомные орбитали, третий — 9 атомных орбиталей, четвёртый — 16 атомных орбиталей.
Число электронов на каждой атомной орбитали ограничено. В соответствии с принципом В. Паули, на атомной орбитали не может находиться более двух электронов. Следовательно, первый энергетический уровень максимально вмещает только 2 электрона, второй уровень — максимально 8 электронов, третий уровень — 18 электронов, четвёртый уровень — 32 электрона. Итог сказанному подведён в виде таблицы (табл. 2):
Таблица 2
|
Энергетический уровень (n) |
Подуровень |
Число атомных орбиталей |
Максимальное число электронов на уровне (2n2) |
|
|
на подуровне |
на уровне (n2) |
|||
|
1 |
1s |
1 |
1 |
2 |
|
2 |
2s |
1 |
4 |
8 |
|
2Р |
3 |
|||
|
3 |
3s |
1 |
9 |
18 |
|
3Р |
3 |
|||
|
3d |
5 |
|||
|
4s |
1 |
|||
|
4 |
4p |
3 |
16 |
32 |
|
4d |
5 |
|||
|
4f |
7 |
|||
Для дальнейшего обсуждения вспомним принцип В. Паули. В соответствии с этим принципом, на одной атомной орбитали не может находиться более двух электронов. Более того, эти электроны должны различаться своим спином. Что же такое спин? На этот вопрос ответить очень сложно. Во многих пособиях спин (от англ. spin — вертеть[-ся]) связывают со способностью электрона вращаться вокруг своей оси (рис. 4).
Поскольку вращение возможно в двух направлениях, то электрон может иметь два различных значения спина.
Однако в действительности такого вращения не происходит. Строго говоря, спином называют собственный момент импульса элементарной частицы, имеющий сугубо квантовую природу и никак не связанный с движением частицы в пространстве. Спин — это внутренняя характеристика электрона, причём характеристика исключительно квантовая, не имеющая аналогий в классической механике, не имеющая наглядного толкования. Это неизменное, неустранимое свойство электрона, такое же, как его масса и заряд. Не вдаваясь в подробности, на первых порах следует запомнить, что:
— электрон обладает спином;
— спин — важная характеристика электрона, не имеющая наглядного толкования;
— для электрона возможны два состояния, отличающиеся спином;
— поскольку спин — величина векторная, для условного обозначения спина используют стрелки, например:
![]()
— если два электрона занимают одну атомную орбиталь, они должны отличаться своим спином, что условно обозначают так:
![]()
Два электрона, находящиеся на одной атомной орбитали, называются спаренными. Они имеют противоположно направленные спины.
Электронные конфигурации атомов
Упрощённая схема строения атома, например натрия, может быть записана следующим образом (рис. 5).
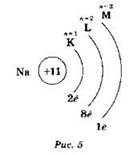
В центре изображено ядро с указанием его заряда: +11, следовательно, в атоме натрия 11 электронов, они распределены по трём энергетическим уровням, изображённым в виде дуг. Обозначения уровней даны вверху схемы. Цифры под дугами показывают число электронов на данных уровнях. В атоме натрия на первом уровне находятся 2 электрона, на втором — 8 электронов и на третьем (внешнем) — 1 электрон.
При более подробном описании электронного строения атома принято записывать его электронную конфигурацию.
Электронная конфигурация показывает распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям. Электронная конфигурация составляется в соответствии с принципом минимума энергии — вначале электронами заполняются атомные орбитали с наименьшей энергией, расположенные ближе к ядру. Экспериментально установлено, что атомные орбитали заполняются электронами в следующем порядке:
![]()
Обратите внимание: сначала заполняется 4в-атомная орбиталь и лишь затем — 3d. Причины этого изучаются в старшей школе.
Составляя электронную формулу атома, сначала цифрой указывают номер энергетического уровня, затем буквой (s, р, d, f) обозначают подуровень и, наконец, указывают число электронов на данном подуровне (в виде верхнего индекса). Так, запись 1s2 означает, что на 1s-подуровне находятся два электрона.
Для составления электронной формулы любого атома достаточно знать порядковый номер элемента в Периодической системе (это даёт число электронов в атоме), номер периода (указывает на число энергетических уровней, заполняющихся электронами) и приведённую выше последовательность заполнения атомных орбиталей электронами.
Рассмотрим электронное строение атомов первых четырёх периодов Периодической системы Д.И. Менделеева.
Первый период содержит 2 элемента — водород и гелий. Атом водорода имеет 1 электрон, располагающийся на 1s-подуровне, что записывается следующей электронной формулой:
![]()
Иногда используют так называемые графические электронные формулы, в которых каждая атомная орбиталь обозначается условно квадратиком, а каждый электрон — стрелкой. Для атома водорода графическая электронная формула выглядит так:
![]()
Атом гелия содержит 2 электрона, оба они размещаются на 1s-орбитали:
![]()
Или в графическом виде:
![]()
Обратите внимание на взаимное расположение стрелок: в соответствии с принципом В. Паули, 2 электрона, занимая одну атомную орбиталь, должны различаться своим спином.
На этом первый уровень, максимально вмещающий 2 электрона, полностью заполнен. Именно поэтому первый период Периодической системы Д.И. Менделеева содержит только 2 элемента.
Второй период начинается элементом литием и заканчивается элементом неоном. Все электроны в атомах элементов второго периода располагаются на двух энергетических уровнях.
В атоме лития всего 3 электрона, два из них находятся на первом энергетическом уровне и занимают 1s-орбиталь, третий электрон, в соответствии с вышесказанным, находится на втором энергетическом уровне, занимая 2s-орбиталь. Электронная конфигурация атома лития:
![]()
Строение внешнего электронного уровня можно записать в графическом виде:
![]()
За литием в Периодической системе следует элемент бериллий. Электронная конфигурация атома бериллия:
![]()
Строение внешнего электронного уровня можно записать в графическом виде:
![]()
На этом 2s-подуровень полностью заполнился. В атоме бора следующий электрон расположится на р-подуровне:
![]()
или в графическом виде:
![]()
В атомах следующих элементов (углерод, азот, кислород, фтор и неон) каждый последующий электрон также располагается на р-подуровне. Если элементы Li и Be относятся к s-элементам, то В, С, N, О, F и Ne — к р-элементам.
Электронные конфигурации атомов от углерода до неона таковы:
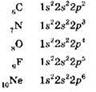
Изображая графическую электронную формулу атомов p-элементов, следует руководствоваться правилом Хунда, в соответствии с которым электроны так располагаются в пределах подуровня, чтобы суммарный спин был максимальным (т. е. число неспаренных электронов должно быть наибольшим). Так, для атома углерода можно изобразить строение внешнего электронного уровня двумя способами:
![]()
Очевидно, что только вторая схема отвечает правилу Хунда. Аналогично, в атоме азота, находящемся в основном состоянии, имеется три неспаренных электрона:
![]()
Начиная с атома кислорода, каждый следующий р-электрон попадает на атомную орбиталь, уже занятую одним электроном. Это приводит к спариванию электронов на р-орбиталях:
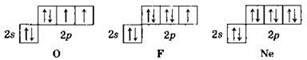
Таким образом, в атоме неона все электроны — спаренные. Кроме того, в атоме неона полностью завершен не только р-подуровень, но и весь второй энергетический уровень (8 электронов). Вот почему второй период Периодической системы Д.И. Менделеева содержит 8 элементов.
В третьем периоде Периодической системы Д.И. Менделеева расположены также 8 элементов, это s-элементы натрий и магний:
![]()
и p-элементы — алюминий, кремний, фосфор, сера, хлор и аргон:

Элементом аргоном третий период заканчивается.
Казалось бы, на третьем уровне остались вакантными 3d-орбитали, и именно они должны заполняться электронами после того, как в атоме аргона полностью заполнился 3р-подуровень. Однако после аргона в атомах калия и кальция начинают заполняться 4s-орбитали:
![]()
Таким образом, четвёртый период, как и другие периоды, начинается с s-элементов — калия и кальция, в атомах которых происходит заполнение электронами 4s-орбиталей. Это становится возможным с учётом того, что в атомах этих элементов энергия 4s-подуровня меньше энергии 3d-подуровня. И только после заполнения 4s-оболочки происходит заполнение вакантной 3d-оболочки. Первый 3d-электрон появляется в атоме скандия***:
![]()
Скандий и последующие элементы называются 3d-элементами, всего их десять (т. к. на пяти d-орбиталях может максимально разместиться 10 электронов). d-Элементы наряду с f-элементами относятся к так называемым переходным элементам. Переходные элементы всегда располагаются в побочных подгруппах Периодической системы.
Приведём электронные конфигурации переходных элементов четвёртого периода:

Обратите внимание на электронные конфигурации атомов хрома и меди. Вместо конфигурации 3d44s2 атом хрома имеет конфигурацию 3d54s1. Это связано с переходом одного из 4s-электронов на 3d-подуровень, что объясняют повышенной устойчивостью наполовину заполненной d-оболочки. Аналогичный “провал электрона” имеет место и в атоме меди, что связано с повышенной устойчивостью полностью заполненной d-оболочки.
После заполнения 3d-подуровня происходит заполнение электронами 4р-подуровня. Электронные конфигурации остальных элементов четвёртого периода таковы:
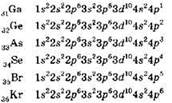
В атоме криптона заканчивается заполнение p-подуровня, криптон — последний элемент четвёртого периода. Всего в четвёртом периоде 18 химических элементов — 2 s-элемента, 10 d-элементов и 6 р-элементов.
Электроны, находящиеся на последнем энергетическом уровне, называются внешними электронами. Так, в атоме фосфора (элемент 3 периода) внешними являются 3s23р3-электроны, в атоме железа (элемент 4 периода) внешними являются 4s2-электроны, в атоме брома (элемент 4 периода) внешними являются 4s24р5-электроны.
Электроны, которые могут принимать участие в образовании химических связей, называются валентными электронами. Для элементов главных подгрупп валентными являются внешние s- и р-электроны. Для элементов побочных подгрупп валентными являются внешние s- и предвнешние d-электроны. Так, валентными электронами являются:
— для атома фосфора — 3s23р3-электроны (5 валентных электронов),
— для атома железа — 3d64s2-элeктpoны (8 валентных электронов),
— для атома брома — 4s24р5-электроны (7 валентных электронов).
Число валентных электронов в большинстве своём равно номеру группы, в которой располагается элемент в Периодической системе.
Задания
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Атомы химических элементов бора и алюминия имеют одинаковое число
1) заполненных электронных слоев
2) протонов в ядре
3) электронов во внешнем электронном слое
4) электронов в атоме
2. Химическому элементу 3-го периода VA группы соответствует схема распределения электронов по слоям:
1) 2, 8, 5
2) 2, 8, 3
3) 2, 5
4) 2, 3
3. Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого:
1) +6 2ē, 4ē
2) +12 2ē, 8ē, 2ē
3) +8 2ē, 6ē
4) +7 2ē, 5ē
4. Химическому элементу, степень окисления которого в водородном соединении равна -1, соответствует схема распределения электронов в атоме:
1) 2ē, 8ē, 1ē
2) 2ē, 8ē, 4ē
3) 2ē, 8ē, 7ē
4) 2ē, 8ē, 8ē
5. Химическому элементу, степень окисления которого в высшем оксиде +6, соответствует схема распределения электронов в атоме:
1) 2ē, 8ē, 6ē
2) 2ē, 8ē, 8ē, 2ē
3) 2ē, 8ē, 3ē
4) 2ē, 6ē
6. По 5 электронов на внешнем электронном слое находится в атоме каждого из химических элементов в ряду:
1) Be, В, Li
2) As, Se, Вг
3) С, Si, Al
4) N, P, As
7. По 3 электрона находится во внешнем электронном слое атомов каждого из химических элементов в ряду:
1) Mg, Аl, Са
2) В, Al, Ga
3) Si, С, N
4) N, Р, S
8. Химический элемент, в атомах которого распределение электронов по слоям 2, 8, 6, образует высший оксид:

9. Химический элемент, в атомах которого распределение электронов по слоям 2, 8, 4, образует водородное соединение:
1) CH4
2) NH3
3) SiH4
4) H2S
10. Четыре электронных слоя и 7 электронов во внешнем электронном слое имеет атом
1) углерода
2) калия
3) брома
4) кремния
11. Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду:
1) С, Si, Sn
2) О, Cl, I
3) N, C, S
4) Mg, Be, Ca
12. Химический элемент расположен в 4-м периоде IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2, 8, 8, 2
2) 2, 8, 18, 1
3) 2, 8, 8, 1
4) 2, 8, 18, 2
13. Строение электронной оболочки атома магния отражает электронная формула
1) 1s22s2
2) 1s22s22p63s23p2
3) 1s22s22p63s2
4) 1s22s22p2
14. В атоме азота число заполняемых энергетических уровней и число внешних электронов соответственно равно
1) 2 и 3
2) 2 и 5
3) 3 и 7
4) 3 и 5
15. Число заполняемых энергетических уровней и число внешних электронов атома хлора соответственно равно
1) 4 и 6
2) 2 и 5
3) 3 и 7
4) 4 и 5
16. Число заполняемых энергетических уровней и число внешних электронов атома алюминия соответственно равно
1) 2 и 1
2) 2 и 3
3) 3 и 3
4) 3 и 2
17. Какой из частиц соответствует электронная конфигурация атома 1s22s22p63s23p6?
1) Li+
2) К+
3) Cs+
4) Na+
18. Какой из частиц соответствует электронная конфигурация атома 1s22s22p63s23p6?
1) N-3
2) Сl-
3) S+4
4) Na+
19. Восемь электронов на внешнем энергетическом уровне имеет ион
1) Р3+
2) S2-
3) Сl5+
4) H+
20. Восьмиэлектронную внешнюю оболочку имеет ион
1) N3-
2) S4+
3) Вr5+
4) N2+
21. Число электронов в ионе железа Fe2+ равно
1) 54
2) 28
3) 58
4) 24
22. Число электронов в атоме аргона равно числу электронов в ионе
1) S2-
3) Na+
2) Аl3+
4) F-
При выполнении заданий выберите правильные ответы. Установите соответствие.
23. Установите соответствие между формулой частицы и её электронным строением.
|
ФОРМУЛА ЧАСТИЦЫ A) Na+ Б) Аr В) S2- Г) N5+ |
ЭЛЕКТРОННОЕ СТРОЕНИЕ 1) 1s2 2) 1S22S2 3) 1s22s22p3 4) 1s22s22p6 5) 1s22s22p63s1 6) 1s22s22p63s23p6 |
|
A |
Б |
В |
Г |
24. Установите соответствие между формулой частицы и её электронным строением.
|
ФОРМУЛА ЧАСТИЦЫ A) Mg2+ Б) Аl В) S4+ Г) N3- |
ЭЛЕКТРОННОЕ СТРОЕНИЕ 1) 1S22S2 2) 1s22s22p1 3) 1s22s22p63s23p1 4) 1s22s22p6 5) 1s22s22p63s23p2 6) 1s22s22p63s2 |
|
A |
Б |
В |
Г |
*Другая причина связана с так называемым дефектом массы при образовании ядра из отдельных нуклонов. Более подробно об этом говорится в старших классах на уроках физики.
**Более строгое определение атомной орбитали даётся в курсе химии высшей школы.
***Обратите внимание, что заполняется сначала 4а-подуровень, а затем — 3d, а записывается в электронной формуле сначала 3d- подуровень, а затем 4s (в порядке увеличения номера энергетического уровня).