Химия - Универсальный справочник школьника подготовка к ЕГЭ
ЭКСПРЕСС-ПОМОЩНИК - Урок 1 - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Состав ядра
|
Название |
Обозначение |
Масса |
Заряд |
|
Электрон |
ē |
≈ 0 |
-1 |
|
Протон |
з |
1 |
+1 |
|
Нейтрон |
n |
1 |
0 |
Разновидности атомных ядер с фиксированным массовым числом A, числом протонов Z и нейтронов N
|
Изотопы |
Изотоны |
Изобары |
|
Разновидности атомов одного химического элемента, имеющие одинаковые заряды ядер, но разные массовые числа изотопы кислорода: 168O; 178O; 188O; изотопы водорода: 11H протий; 21H — D дейтерий; 31H — Tтритий; изотопы калия: 3919K; 4019K; 4119K |
Разновидности атомов разных химических эле ментов, имеющие одинаковое количество нейтронов, но разные атомные номера 22828Ra; 23090Th; 23191Pa |
Разновидности атомов разных химических элементов, имеющих одинаковые массовые числа, но разные атомные номера 4018Ar; 4019K; 4020Ca |
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы нуклида углерода 12C
![]()
Атомная единица массы (а. е. м.) обозначается u:
![]()
Порядок заполнения орбиталей
|
Увеличение энергии орбиталей
|
|
Принцип Паули На каждой орбитали могут находиться не более двух электронов, причем спины их противоположны.
|
|
Правило Хунта Орбитали заполняются электронами так, чтобы их суммарный спин был максимальным.
|
|
|
Свойства различных видов химической связи
|
Ковалентная связь |
Ионная связь |
Металлическая связь |
|
• Насыщенность — способность атома образовывать ограниченное число ковалентных связей • Направленность — определенная ориентация связей в пространстве • Поляризуемость — способность электронов в молекуле (или атоме) смещаться под действием внешнего электрического поля |
• Ненасыщаемость • Ненаправленность |
• Ненаправленность • Делокализованный характер |
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровнями
|
Энергетический уровень |
Число подуровней |
Энергетический подуровень |
Общее число орбиталей |
Наибольшее число электронов |
Электронная формула заполненного энергетического уровня |
||
|
на энергетическом подуровне |
на энергетическом уровне |
||||||
|
1 |
1 |
s |
1 |
2 |
2 |
1s2 |
|
|
2 |
2 |
s p |
|
|
2 6 |
8 |
2s22p6 |
|
3 |
3 |
s p d |
|
2 6 10 |
18 |
3s23p63d10 |
|
|
4 |
4 |
s p d f |
|
2 6 10 14 |
32 |
4s24p64d104f14 |
|
Закон Авогадро
Равные объемы разных газов при одинаковых условиях содержат одинаковое количество молекул
Следствия из закона Авогадро
|
Один моль любого газа при одинаковых условиях занимает одинаковый объем (молярный объемVm) |
Нормальные условия (н. у.) T = 273К = 0 °С P = 101,325 кПа = 760 мм рт. ст. Vm = const = 22,4 л/моль |
Формулы для расчетов
|
Vm — молярный объем газа (л/моль); V — объем газа (л); v — количество вещества газа (моль)
D — относительная плотность; m1, m2 — массы одинаковых объемов газов; M1, М2 — молярные массы разных газов |
Пример. Относительная плотность газа по водороду:
Относительная плотность газа по воздуху:
M (воздуха) = 29 г/моль |
Закон объемных отношений газов
|
Объемы газов, вступающих в химическую реакцию и образующихся во время реакции, относятся между собой как небольшие целые числа (как их коэффициенты) |
|
Пример: |
|
|
Уравнение Менделеева – Клапейрона

где p — давление (кПа); V — объем (л); v — количество вещества газа (моль); m — масса (г); M — молярная масса (г/моль); T — температура (K); R — универсальная газовая постоянная, ![]()
Таблица растворимости
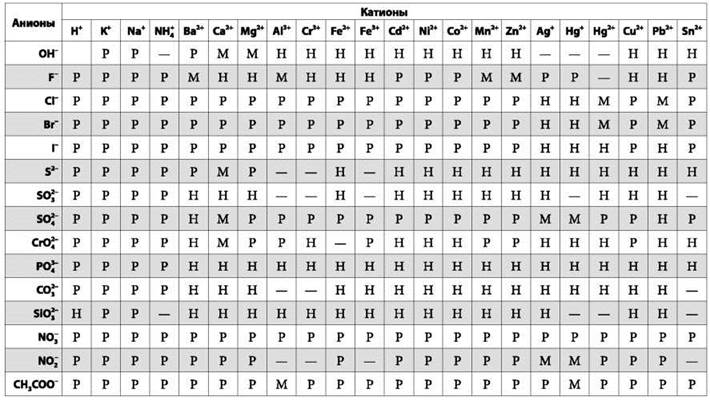
Р — растворяется в воде; М — мало растворяется в воде; Н — не растворяется в воде; прочерк— не существует или распадается в водной среде
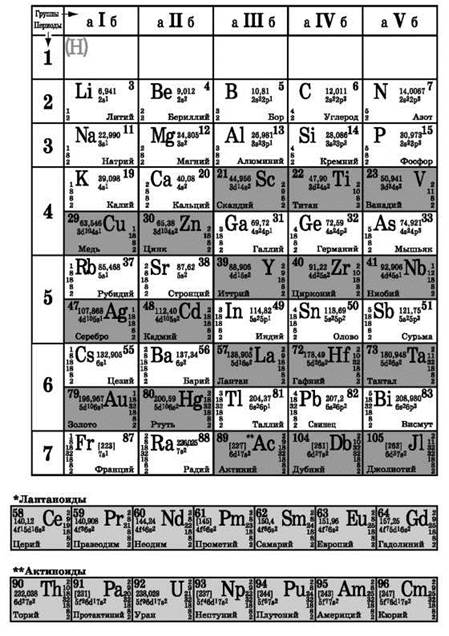
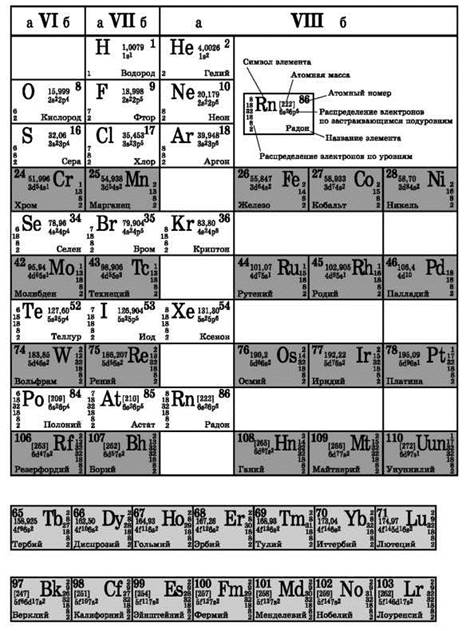
Периодическая система химических элементов Д. И. Менделеева
Электроотрицательность химических элементов (по шкале Оллреда - Рохова)
|
Элемент |
ЭО |
Элемент |
ЭО |
Элемент |
ЭО |
|
Cs |
0,86 |
Mn |
1,60 |
Sc |
1,20 |
|
Cu |
1,75 |
Mo |
1,30 |
Se |
2,48 |
|
F |
4,10 |
N |
3,07 |
Si |
1,74 |
|
Fe |
1,64 |
Na |
1,01 |
Sn |
1,72 |
|
Ft |
0,86 |
Nb |
1,23 |
Sr |
0,99 |
|
Ga |
1,82 |
Ni |
1,75 |
Та |
1,33 |
|
Ge |
2,02 |
О |
3,50 |
Тс |
1,36 |
|
H |
2,10 |
P |
2,10 |
Те |
2,01 |
|
Hf |
1,23 |
Pb |
1,55 |
Ti |
1,32 |
|
Hg |
1,44 |
Po |
1,76 |
Tl |
1,44 |
|
I |
2,21 |
Pt |
1,44 |
V |
1,45 |
|
In |
1,49 |
Ra |
0,97 |
W |
1,40 |
|
К |
0,91 |
Rb |
0,89 |
Y |
1,1 |
|
La |
1,08 |
Re |
1,46 |
Zn |
1,66 |
|
Li |
0,97 |
S |
2,60 |
Zr |
1,22 |
|
Mg |
1,23 |
Sb |
1,82 |
|
|