Химия - Универсальный справочник школьника подготовка к ЕГЭ
Общие способы получения металлов - Общие научные принципы химического производства - ХИМИЯ И ЖИЗНЬ
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д.
В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Ag, Hg, Pt, Au, Cu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
![]()
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы. В соответствии с этим существуют следующие способы получения металлов:
· пирометаллургический;
· гидрометаллургический;
· электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита Sn02, а медь — из куприта Cu20 прокаливанием с углем (коксом):
![]()
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
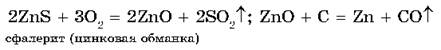
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
![]()
Восстановлением углем можно получить Fe, Cu, Zn, Cd, Ge, Sn, Pb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
1) MoO3 + 3H2 = Mo + 3H2O (водородотермия)
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2 + 2Mg = Ti + 2MgO (магнийтермия)
3MnO2 + 4Al = 3Mn + 2Al2O3 (алюминотермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида которого очень велика (2Al + 1,5O2 = Al2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
![]()
где Q1 — теплота образования продукта, Q2 — теплота образования исходного вещества.
Гидрометаллургия — это восстановление металлов из их солей в растворе. Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди CuO, ее обрабатывают разбавленной серной кислотой:
CuO + H2SO4 = CuSO4 + H2O
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Таким образом получают серебро, цинк, молибден, золото, уран.
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.