Химия - Универсальный справочник школьника подготовка к ЕГЭ
Тепловой эффект химической реакции. Термохимические уравнения - ХИМИЧЕСКАЯ РЕАКЦИЯ
Почему протекают химические реакции
Определение возможности осуществления той или иной реакции — одна из основных задач, которая стоит перед химиками.
В одних случаях (например, при обжиге известняка: ![]() ) достаточно повысить температуру, чтобы реакция началась, а в других (например, восстановление кальция из его оксида водородом:
) достаточно повысить температуру, чтобы реакция началась, а в других (например, восстановление кальция из его оксида водородом: ![]() ) реакцию невозможно осуществить ни при каких условиях!
) реакцию невозможно осуществить ни при каких условиях!
Один из наиболее важных законов природы (первый закон термодинамики) — это закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
- ЗАПОМНИ. Первый закон термодинамики или закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
В общем случае энергия объекта складывается из трех ее основных видов: кинетической, потенциальной, внутренней. Внутренняя энергия складывается из кинетической энергии движения атомов, молекул, ионов; из энергии их взаимного притяжения и отталкивания; из энергии, связанной с движением электронов в атоме, их притяжением к ядру, взаимным отталкиванием электронов и ядер, а также внутриядерной энергии.
- ЗАПОМНИ. Экзотермическими называются химические реакции, протекающие с выделением теплоты. Эндотермическими называются химические реакции, протекающие с поглощением тепла.
При химических реакциях одни химические связи разрушаются, а другие образуются; при этом изменяется электронное состояние атомов, их взаимоположение, а потому и внутренняя энергия продуктов реакции отличается от внутренней энергии реагентов.
Рассмотрим два возможных случая.
1. E(реагентов) > E(продуктов). Исходя из закона сохранения энергии в результате такой реакции энергия должна выделяться в окружающую среду: нагревается воздух, пробирка, автомобильный двигатель, продукты реакции.
Реакции, при которых выделяется энергия и нагревается окружающая среда, называют экзотермическими.
2. E E(реагентов) < E(продуктов). Исходя из закона сохранения энергии следует предположить, что исходные вещества при таких процессах должны поглощать энергию из окружающей среды, температура реагирующей системы должна понижаться.
Реакции, при протекании которых энергия поглощается из окружающей среды, называют эндотермическими.
Тепловой эффект химической реакции
Энергия, которая выделяется или поглощается в химической реакции, называется тепловым эффектом этой реакции. Данный термин используют повсеместно, хотя точнее было бы говорить об энергетическом эффекте реакции.
Тепловой эффект реакции выражается в единицах энергии. Энергия отдельных атомов и молекул — величина незначительная. Поэтому тепловые эффекты реакций относят обычно к тем количествам веществ, которые определены уравнением, и выражают в джоулях или килоджоулях.
Термохимическое уравнение
Уравнение химической реакции, в котором указан тепловой эффект называется термохимическим уравнением.
Например, термохимическое уравнение:
2H2 + O2 = 2H2O + 484 кДж
Если реакция проходит между несложными молекулами, то подсчитать тепловой эффект реакции достаточно просто. Например:
![]()
Энергия затрачивается на разрыв двух химических связей H—H и Cl—Cl, энергия выделяется при образовании двух химических связей H—Cl. Именно в химических связях сосредоточена важнейшая составляющая внутренней энергии соединения. Зная энергии этих связей, можно по разности узнать тепловой эффект реакции (Qp).
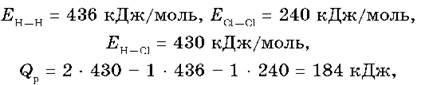
следовательно, данная реакция — экзотермическая.
А как, например, рассчитать тепловой эффект реакции разложения карбоната кальция? Ведь это соединение немолекулярного строения. Как точно определить, какие именно связи и сколько их разрушается, какова их энергия, какие связи и сколько их образуется в оксиде кальция?
- ЗАПОМНИ. Знание тепловых эффектов химических реакций имеет большое практическое значение. Например, при проектировании химического реактора важно предусмотреть или приток энергии для поддержания реакции путем подогрева реактора, или, наоборот, отвод избытка теплоты, чтобы не было перегрева реактора со всеми вытекающими отсюда последствиями, вплоть до взрыва.
Для расчета тепловых эффектов реакций используют значения величин теплот образования всех участвующих в реакции химических соединений (исходных и продуктов).
Теплота образования соединения (Qo6p.) — это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в стандартных условиях (25 °С, 1 атм).
При этих условиях теплота образования простых веществ равна нулю по определению.
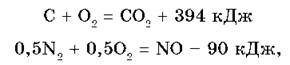
где 394 кДж и -90 кДж — теплоты образования CO2 и NO соответственно.