Химия - Универсальный справочник школьника подготовка к ЕГЭ
Коррозия металлов - Окислительно-восстановительные реакции (ОВР). Коррозия металлов и способы защиты от нее - ХИМИЧЕСКАЯ РЕАКЦИЯ
При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто повторяем слова «ржавчина», «ржавление», видя коричнево-желтый налет на изделиях из железа и его сплавов. Ржавление — это частный случай коррозии.
Коррозия — это процесс самопроизвольного разрушения металлов под влиянием внешней среды.
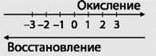
- ЗАПОМНИ. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления:
Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т. д.
Коррозия металлов бывает сплошной и местной. Первая не так опасна, как вторая, ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов — точечная. Она заключается в образовании сквозных поражений, то есть точечных полостей — питтингов, при этом снижается прочность отдельных участков, уменьшается надежность конструкций, аппаратов, сооружений.
По своей химической природе коррозия — это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии.
Виды коррозии
- ЗАПОМНИ. Затраты на возмещение потерь, связанных с коррозией, составляют 30 % годового производства металлов в мире.
Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая.
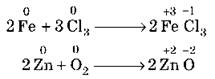
1. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями-неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах. Например:
![]()
Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные пленки. Если эта пленка прочная, плотная, хорошо связана с металлом, то она защищает металл от разрушения. Такие защитные пленки появляются у Zn, Al, Cr, Ni, Pb, Sn, Nb, Ta и др. У железа она рыхлая, пористая, легко отделяется от поверхности и поэтому не способна защитить металл от дальнейшего разрушения.
2. Электрохимическая коррозия происходит в токопроводящей среде (в электролите с возникновением внутри системы электрического тока). Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Например, на железе, как на более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
![]()
Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к олову — металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Таким образом, участки олова могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь олова выполняет роль катода.
В зависимости от среды электролита на катоде могут идти различные процессы. В одном случае будет наблюдаться выделение газа (Н2). В другом — образование ржавчины, состоящей в основном из Fe2O3 · nH2O.
Катионы водорода и растворенный кислород — важнейшие окислители, вызывающие электрохимическую коррозию.
Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов — чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры.
Электролитом может служить морская вода, речная вода, конденсированная влага и, конечно же, хорошо известные вам электролиты — растворы солей, щелочей, кислот.
Способы защиты от коррозии
Уже при проектировании металлических конструкций и их изготовлении предусматривают меры защиты от коррозии.
1. Шлифование поверхности изделий, чтобы на них не задерживалась влага.
2. Применение легированных сплавов, содержащих специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой (например, Cr2O3). Общеизвестны легированные стали — «нержавейки», из которых изготавливают предметы домашнего обихода (ножи, вилки, ложки), детали машин, инструменты.
3. Нанесение защитных покрытий. Рассмотрим их виды:
1) неметаллические — неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы;
2) химические — искусственно создаваемые поверхностные пленки: оксидные, нитридные, силицидные, полимерные и др.
Например, все стрелковое оружие и детали многих точных приборов подвергают воронению — это процесс получения тончайшей пленки оксидов железа на поверхности стального изделия. Получаемая искусственная оксидная пленка очень прочная (в основном состава ![]() ) и придает изделию красивый черный цвет и синий отлив. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии;
) и придает изделию красивый черный цвет и синий отлив. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии;
3) металлические — это покрытия другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность — хромирование, никеля — никелирование, цинка — цинкование, олова — лужение и т. д. Покрытием может служить и пассивный в химическом отношении металл — золото, серебро, медь.
4. Электрохимические методы защиты:
1) протекторная (анодная) — к защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других стальных изделий используют магний, алюминий, цинк;
2) катодная — металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность ее анодного разрушения.
5. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая конструкция:
1) Введение веществ-ингибиторов, замедляющих коррозию. Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавлением пивных дрожжей, муки, крахмала. Эти примеси и были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате растворялись только окалина и ржавчина. Уральские оружейники применяли для этих целей «травильные супы» — растворы серной кислоты с добавкой мучных отрубей.
Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бути л амина, а серная кислота — азотной кислотой, летучий диэтиламин впрыскивают в различные емкости. Отметим, что ингибиторы действуют только на металл, делая его пассивным по отношению к среде, например, к раствору кислоты. Науке известно более 5 тыс. ингибиторов коррозии.
2) Удаление растворенного в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.