Химия - Универсальный справочник школьника подготовка к ЕГЭ
Строение электронных оболочек атомов элементов первых четырех периодов периодической системы Д. И. Менделеева - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Элементы первого периода
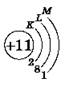
Схема электронного строения атома водорода:
![]()
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронная формула атома водорода (читается: один-эс-один):
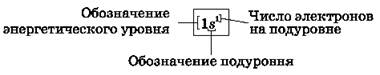
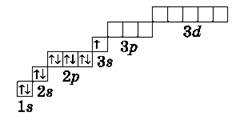
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
![]()
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.

В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем 8 электронов.
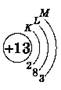
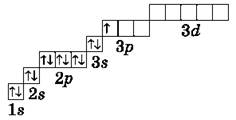
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-подуровни (табл. 1).
Таблица 1
Строение электронных оболочек атомов элементов третьего периода
|
Схема электронного строения |
Электронная формула |
Графическая электронная формула |
|
11Na Натрий |
||
|
|
|
|
|
13Al Алюминий |
||
|
|
|
|
У атома магния достраивается 3s-электронная орбиталь. Na и Mg — s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar — р-элементы. s- и p-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
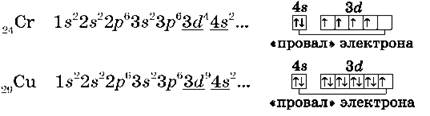
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr — р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s → 4d → 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42Мо, 44Ru,45Rh, 46Pd, 47Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Cs и 56Ва — 6s-элементы; 57La ... 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf - 80Hg — 5d-элементы; 81Тl - 86Rn — 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока (рис. 4):
1. s-элементы. Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
2. p-элементы. Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
3. d-элементы. Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
4. f-элементы. Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
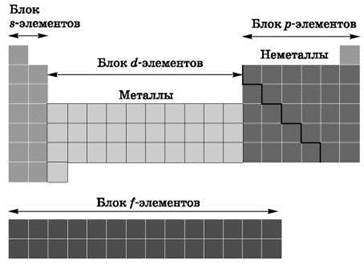
Рис. 4. Блоки химических элементов
Электронная конфигурация атома. Основное и возбужденное состояния
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули. Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами.
На рис. 5 показана схема подразделения энергетических уровней на подуровни.
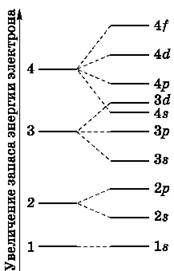
Рис. 5. Схема подразделения энергетических уровней
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.