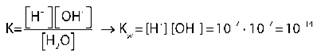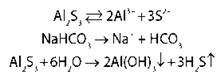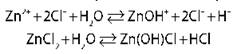Химия - Универсальный справочник школьника подготовка к ЕГЭ
ЭКСПРЕСС-ПОМОЩНИК - Урок 2 - ХИМИЧЕСКАЯ РЕАКЦИЯ
Классификация химических реакций по признакам
|
По числу и составу исходных веществ и продуктов реакции |
соединения MgO + CO2 = MgCO3 |
|
разложения
|
|
|
замещения 2NaBr + Cl2 = 2NaCl + Br2 |
|
|
обмена
|
|
|
без изменения качественного состава — образование аллотропных модификаций 3O2 = 2O3 |
|
|
По тепловому эффекту (ТЭР) |
экзотермические H2 + Cl2 = 2HCl + 184,6 кДж |
|
эндотермические N2 + O2 = 2NO - 180,8 кДж |
|
|
По изменению степени окисления элементов |
окислительно-восстановительные
|
|
без изменения степени окисления элементов CaO + H2O = Ca(OH)2 |
|
|
По обратимости реакции |
обратимые
|
|
необратимые
|
|
|
По наличию катализатора |
каталитические
|
|
некаталитические
|
|
|
! Существуют и другие классификации: по агрегатному состоянию веществ, по механизму и т. д. |
|
Скорость химической реакции (средняя)
|
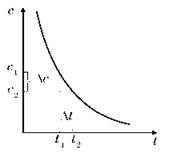
Изменение количества вещества (Δv) реагента или продукта реакции за определенный отрезок времени (Δt)
«-» — для реагентов; «+» — для продуктов реакции |
|
|
Для реакций в растворе количество вещества относят к единице объема реакционного пространства
|
Для гетерогенных реакций количество вещества относят к единице поверхности
|
|
График зависимости концентрации реагентов от времени реакции |
|
|
|
|
|
|
|
|
|
|
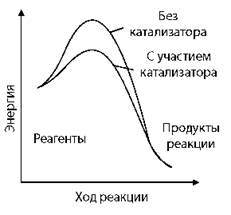
Механизм действия катализатора
Для реакции A + B = AB (при участии катализатора К)
![]()
АК — промежуточное соединение
Диссоциация воды
|
|
|
Установлено опытным путем: в 1 л воды при t = 25 °С диссоциируют 10-7 моль/л молекул воды, образуется 10-7 моль/л Н+ и 10-7 моль/л OH- |
|
[H+] = [OH-] = 10-7 моль/л [H+], [OH] — равновесные концентрации ионов водорода и гидроксид-ионов
KW — ионное произведение воды |
|
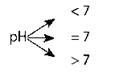
pH — водородный показатель — десятичный логарифм концентрации ионов водорода, взятый с противоположным знаком
[H+] > [OH-] кислая среда [H+] = [OH-] нейтральная среда [H+] < [OH-] щелочная среда |
Гидролиз ковалентных соединений
Большинство соединений в воде на ионы не распадаются, а подвергаются полному гидролитическому разложению
![]()
Процесс взаимодействия соли с водой, приводящий к образованию слабого электролита
|
Тип соли |
Ход гидролиза |
|
Соль образована сильным основанием и слабой кислотой |
Na2CO3 → 2Na+ + CO32- I ст. Fe23+(SO4)3 pH > 7, среда щелочная II ст. Na2CO3 → 2Na+ + CO22- практически не происходит, поэтому HCO3-. Na2CO3 + H2O → NaHCO3 + NaOH Гидролиз по аниону |
|
Соль образована сильным основанием и сильной кислотой |
NaCl → Na+ + Cl- Гидролиз невозможен, pH = 7, среда нейтральная |
|
Соль образована слабым основанием и слабой кислотой |
гидролиз происходит практически необратимо Полный гидролиз |
|
Соль образована слабым основанием и сильной кислотой |
ZnCl2 → Zn+ + 2Cl- I ст. Zn2+ + H2O → ZnOH+ + H+ pH < 7, среда кислая II ст. ZnOH+ + H2O → Zn(OH)2 + H+ практически не происходит, поэтому
Гидролиз по катиону |
Изменение окраски индикаторов в зависимости от среды раствора
|
Индикатор |
Нейтральная среда |
Кислая среда |
Щелочная среда |
|
Лакмус |
фиолетовый |
красный |
синий |
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Метиловый оранжевый |
оранжевый |
розовый |
желтый |
Качественные реакции на катионы
|
Катион |
Условие, реактив, анион |
Признаки, сокращенное ионное уравнение реакции |
|
H+ |
1. Лакмус 2. Метиловый оранжевый |
1. Красный цвет раствора 2. Розовый цвет раствора |
|
NH4+ |
Щелочь, OH-, t |
Выделение газа с резким запахом
|
|
Ag+ |
Соляная кислота, растворы хлоридов, Cl- |
Белый творожистый осадок
|
|
Li+ |
Пламя |
Красное окрашивание |
|
Na+ |
Пламя |
Желтое окрашивание |
|
K+ |
Пламя |
Фиолетовое окрашивание |
|
Ca2+ |
1. Пламя 2. Растворы карбонатов, CO32- |
1. Кирпично-красное окрашивание 2. Белый осадок
|
|
Ba2+ |
1. Пламя 2. Серная кислота, растворы сульфатов, SO42- |
1. Желто-зеленое окрашивание 2. Белый (мелкокристаллический) осадок
|
|
Cu2+ |
1. Пламя 2. Вода 3. Щелочь, OH- |
1. Зеленое окрашивание 2. Гидратированные ионы Cu2+ имеют голубую окраску. 3. Синий осадок
|
|
Fe2+ |
1. Щелочь, OH- 2. Красная кровяная соль K3[Fe(CN)6], Fe(CN)63- |
1. Зеленоватый осадок
2. Синий осадок (турнбулева синь)
|
|
Fe3+ |
1. Щелочь, OH- 2. Роданид аммония NH4SCN, SCN- 3. Желтая кровяная соль K4[Fe(CN)6] |
1. Бурый осадок
2. Кроваво-красный осадок
3. Темно-синий осадок (берлинская лазурь)
|
|
Al3+ |
Щелочь, OH- |
Желеобразный осадок белого цвета, «растворяется» в избытке раствора щелочи
|
Качественные реакции на анионы
|
Анион |
Условие, реактив, катион |
Признаки, сокращенное ионное уравнение реакции |
|
Cl- |
Нитрат серебра, Ag+ |
Белый творожистый осадок
|
|
Br- |
Нитрат серебра, Ag+ |
Желтоватый творожистый осадок
|
|
I- |
Нитрат серебра, Ag+ |
Желтый творожистый осадок
|
|
SO42- |
Растворимые соли бария, Ba2+ |
Белый осадок
|
|
NO3- |
H2SO4(конц.) и Cu, t |
Выделение бурого газа
|
|
PO43- |
Нитрат серебра, Ag+ |
Ярко-желтый осадок
|
|
CrO42- |
Растворимые соли бария, Ba2+ |
Желтый осадок
|
|
S2- |
Растворимые соли меди, Cu2+ |
Черный осадок
|
|
CO32- |
Кислоты, H+ |
Бурное выделение газа без запаха
|
|
OH- |
1. Лакмус 2. Фенолфталеин 3. Метиловый оранжевый |
1. Синий цвет раствора 2. Малиновый цвет раствора 3. Желтый цвет раствора |