Химия - Универсальный справочник школьника подготовка к ЕГЭ
Основания, амфотерные гидроксиды - Характерные химические свойства неорганических веществ различных классов - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Классификация оснований
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-OH).
Общая формула ![]() где у — число гидроксогрупп, равное степени окисления металла
где у — число гидроксогрупп, равное степени окисления металла ![]()
В таблице 2 представлена классификация оснований.
Таблица 2
Классификация оснований
|
Признаки классификации |
Группы оснований |
Примеры |
|
Растворимость в воде |
Растворимые (щелочи) |
NaOH, KOH, Ca(OH)2, Ba(OH)2 |
|
Нерастворимые основания |
Cu(OH)2, Fe(OH)2, Fe(OH)3 |
|
|
Степень электролитической диссоциации |
Сильные (α → 1) |
Щелочи |
|
Слабые (α → 0) |
Нерастворимые основания, водный р-р аммиака NH3 · H2O |
|
|
Кислотность (число гидроксо- групп) |
Однокислотные |
NaOH, KOH |
|
Двухкислотные |
Fe(OH)2, Cu(OH)2 |
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
Ba(OH)2 = Ba2+ + 2OH-
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
NaOH + HCl = NaCl + H2O — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
Ca(OH)2 + HCl = CaOHCl + H2O
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
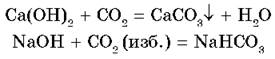
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) сплавление:
2NaOH + ZnO = Na2ZnO2 + H2O
2NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
б) в растворах:
2KOH + H2O + ZnO = K2[Zn(OH)4]
2KOH + Zn(OH)2 = K2[Zn(OH)4]
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
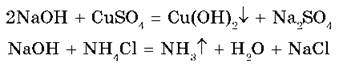
Нерастворимые основания (Cr(OH)3, Mn(OH)2 и др.) взаимодействуют с кислотами и разлагаются при нагревании:
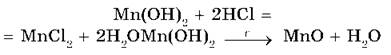
Амфотерные гидроксиды
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, т. е. проявлять основные свойства.
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
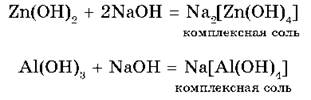
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.