Химия - Универсальный справочник школьника подготовка к ЕГЭ
Углерод и его соединения - Особенности свойств водорода, хлора, брома, йода, кислорода, серы, азота, фосфора, углерода, кремния и их соединений - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Строение и свойства атомов
Углерод (С) — первый элемент главной подгруппы VI группы Периодической системы. Его атомы содержат на внешнем уровне 4 электрона, поэтому они могут принимать четыре электрона, приобретая при этом степень окисления -4, т. е. проявлять окислительные свойства и отдавать свои электроны более электроотрицательным элементам, т. е. проявлять восстановительные свойства, приобретая при этом степень окисления +4.

Углерод — простое вещество
Углерод образует аллотропные модификации алмаз и графит.
Алмаз — прозрачное кристаллическое вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая по десятибалльной системе оценивается высшим баллом 10. Такая твердость алмаза обусловлена особой структурой его атомной кристаллической решети. В ней каждый атом углерода окружен такими же атомами, расположенными в вершинах правильного тетраэдра.
- ЗАПОМНИ. Аллотропные модификации углерода: алмаз, графит, карбин, фуллерен.
Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности. А благодаря исключительно высокой твердости, они применяются для изготовления буров, сверл, шлифовальных инструментов, резки стекла.
Крупнейшие месторождения алмазов находятся в Южной Африке, а в России их добывают в Якутии.
Графит — темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском. В отличие от алмаза графит мягкий (оставляет след на бумаге) и непрозрачный, хорошо проводит тепло и электрический ток. Мягкость графита обусловлена слоистой структурой. В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны. Он очень тугоплавок.
Из графита изготовляют электроды, твердые смазки, замедлители нейтронов в ядерных реакторах, стержни для карандашей. При высоких температурах и давлении из графита получают искусственные алмазы, которые широко применяются в технике.
Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Этот уголь благодаря своей пористой поверхности обладает замечательной способностью поглощать газы и растворенные вещества. Это свойство называется адсорбцией. Чем больше пористость древесного угля, тем эффективнее адсорбция. Чтобы увеличить поглотительную способность, древесный уголь обрабатывают горячим водяным паром. Обработанный таким способом уголь называют активированным или активным. В аптеках его продают в виде черных таблеток карболена.
Химические свойства углерода
Алмаз и графит соединяются с кислородом при очень высокой температуре. Сажа и уголь взаимодействуют с кислородом гораздо легче, сгорая в нем. Но в любом случае результат такого взаимодействия один — образуется углекислый газ:
![]()
С металлами углерод при нагревании образует карбиды:
![]()
Карбид алюминия — светло-желтые прозрачные кристаллы. Известен карбид кальция СаС2 в виде кусков серого цвета. Его применяют газосварщики для получения ацетилена:
![]()
Ацетилен используют для резки и сварки металлов, сжигая его с помощью кислорода в специальных горелках.
Если водой подействовать на карбид алюминия, то получится другой газ — метан СН4:
![]()
Метан можно получить также синтезом из углерода и водорода при нагревании.
Если в пробирке прокалить смесь черного порошка оксида меди (II) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди:
![]()
Оксиды углерода
Углерод образует два оксида — СО и СО2.
Оксид углерода (II) CO — это бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, т. к. он очень ядовит. Попадая при дыхании в кровь, быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин, лишая тем самым возможности гемоглобина переносить кислород. При вдыхании воздуха, содержащего 0,1 % СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива, вот почему так опасно преждевременное закрывание дымоходов.
Оксид СО относят к несолеобразующим оксидам, т. к., будучи оксидом неметалла, он должен реагировать со щелочами и основными оксидами, однако этого не наблюдается.
СО — хороший восстановитель. Он сгорает в кислороде, образуя углекислый газ:
2СО + О2 = 2СО2
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металл из их оксидов:
![]()
Именно это свойство оксида углерода (II) используется в металлургии при выплавке чугуна.
Оксид углерода (IV) CO2, широко известный под названием углекислый газ, — бесцветный, не имеющий запаха газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в одном объеме воды растворяется один объем углекислого газа.
При давлении примерно 60 атм. углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твердую снегообразную массу, которую в промышленности прессуют, — это известный сухой лед, который применяется для хранения пищевых продуктов. Твердый углекислый газ имеет молекулярную решетку и способен к возгонке.
СО2 — это типичный кислотный оксид: взаимодействует со щелочами (вызывает помутнение известковой воды), с основными оксидами и водой.
Он не горит и не поддерживает горения и поэтому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
CO2 + 2Mg = 2MgO + C
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты — растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии на мел или мрамор соляной кислотой:
![]()
В промышленности большие количества углекислого газа получают обжигом известняка:
![]()
Углекислый газ, кроме уже названной области применения, используют для приготовления шипучих напитков и для получения соды.
Угольная кислота и ее соли
При растворении оксида углерода (IV) в воде образуется угольная кислота Н2СО3, которая очень нестойкая и легко разлагается на исходные компоненты — углекислый газ и воду:
![]()
Равновесие этой реакции смещено влево.
Как двухатомная кислота она образует два ряда солей: средние — карбонаты и кислые — гидрокарбонаты. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
СаСО3 + Н2О + СО2 = Са(НСО3)2
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющегося углекислого газа:
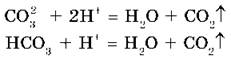
Эта реакция является качественной реакцией на соли угольной кислоты.