Химия - Универсальный справочник школьника подготовка к ЕГЭ
Общая характеристика металлов - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Химические элементы — металлы
Большинство химических элементов относят к металлам — 92 из 114 известных элементов.
Металлы — это химические элементы, атомы которых отдают электроны внешнего (а некоторые — и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Это свойство атомов металлов определяется тем, что они имеют сравнительно большие радиусы и малое число электронов (в основном от 1 до 3 на внешнем слое).
Исключение составляют лишь 6 металлов: атомы германия, олова, свинца на внешнем слое имеют 4 электрона, атомы сурьмы и висмута — 5, атомы полония — 6.
- ЗАПОМНИ. В организме человека найдено 62 металла. Ca, K, Na, Mg присутствуют в больших количествах (макроэлементы), а Cr, Mn, Fe, Co, Zn и др. — в малых (микроэлементы).
Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7 до 1,9) и исключительно восстановительные свойства, т. е. способность отдавать электроны.
В Периодической системе химических элементов Д. И. Менделеева металлы находятся ниже диагонали бор — астат, а также выше ее, в побочных подгруппах. В периодах и главных подгруппах действуют известные вам закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
- ЗАПОМНИ. В побочных подгруппах восстановительные свойства металлов уменьшаются (↓), т. к. на связь валентных электронов с ядром в большей степени влияет величина заряда ядра, а не радиус атома.
Химические элементы, расположенные вблизи диагонали бор — астат (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственными свойствами: в одних своих соединениях ведут себя как металлы, в других — проявляют свойства неметаллов.
- ЗАПОМНИ. Металлы с низкой химической активностью называют благородными: Ag, Au, Pt, Os, Ir, Ru, Pd, Rh.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются. Сравните активность известных вам металлов I группы побочной подгруппы: Cu, Ag, Au; II группы побочной подгруппы: Zn, Cd, Hg — и вы убедитесь в этом сами.
Это можно объяснить тем, что на прочность связи валентных электронов с ядром у атомов данных металлов в большей степени влияет величина заряда ядра, а не радиус атома. Величина заряда ядра значительно увеличивается, притяжение электронов к ядру усиливается. Радиус атома при этом хотя и увеличивается, но не столь значительно, как у металлов главных подгрупп.
- ЗАПОМНИ. Литий — самый легкий металл. Самый тяжелый — осмий. По близости свойств выделяют щелочные, щелочноземельные и редкоземельные металлы (Se, Y, La, Ac).
Простые вещества, образованные химическими элементами — металлами, и сложные металлосодержащие вещества играют важнейшую роль в минеральной и органической «жизни» Земли. Достаточно вспомнить, что атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен веществ в организме человека, животных. Например, в крови человека найдено 76 элементов, и из них только 14 не являются металлами. В организме человека некоторые элементы металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т. е. являются макроэлементами. А такие металлы, как хром, марганец, железо, кобальт, медь, цинк, молибден присутствуют в небольших количествах, т. е. это микроэлементы. Если человек весит 70 кг, то в его организме содержится (в граммах): кальция — 1700, калия — 250, натрия — 70, магния — 42, железа — 5, цинка — 3. Все металлы чрезвычайно важны, проблемы со здоровьем возникают и при их недостатке, и при избытке.
Например, ионы натрия регулируют содержание воды в организме, передачу нервных импульсов. Его недостаток приводит к головной боли, слабости, слабой памяти, потере аппетита, а избыток — к повышению артериального давления, гипертонии, заболеваниям сердца. Специалисты по питанию рекомендуют взрослым потреблять в день не более 5 г (1 чайная ложка) поваренной соли (NaCl).
- ЗАПОМНИ. Пыль и пары некоторых металлов токсичны. Это берклий, ртуть, свинец, кадмий, серебро, никель и др.
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до 3000 °С; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели, необходимых для ее достижения свойств материала.
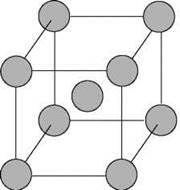
Рис. 15. Кристаллическая решетка натрия
На рис. 15 изображена схема кристаллической решетки металлического натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: 1s22s22p63s13p03d0, где 3s, 3p, 3d — валентные орбитали.
Единственный валентный электрон атома натрия 3s1 может занимать любую из девяти свободных орбиталей — 3s (одна), 3р (три) и 3d (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла. Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рис. 16. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
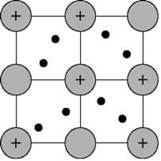
Рис. 16. Металлическая кристаллическая решетка
- ЗАПОМНИ. Свойства веществ существовать в нескольких кристаллических модификациях называют полиморфизмом.
Металлическая связь — это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
- ЗАПОМНИ. Свойства металлов зависят от содержания в них примесей. Титан долгое время не находил применения из-за хрупкости, обусловленной примесями. После его очистки область применения титана резко расширилась. Содержание лишь 0,03 % (мас. доли) мышьяка снижает электропроводность меди на 14 %.
Некоторые металлы кристаллизуются в двух или более кристаллических формах.
Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом. Полиморфизм простых веществ известен под названием аллотропии.
Например, железо имеет четыре кристаллические модификации, каждая из которых устойчива в определенном температурном интервале:
· α — устойчива до 768 °С, ферромагнитная;
· β — устойчива от 768 до 910 °С, неферромагнитная, т. е. парамагнитная;
· γ — устойчива от 910 до 1390 °С, неферромагнитная, т. е. парамагнитная;
· δ — устойчива от 1390 до 1539 °С (t°пл железа), неферромагнитная.
Олово имеет две кристаллические модификации:
· α — устойчива ниже 13,2 °С (ρ = 5,75 г/см3). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
· β — устойчива выше 13,2 °С (ρ = 6,55 г/см3). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже 13,2 °С он рассыпается в серый порошок, т. к. при переходе β → α значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
- ЗАПОМНИ. Сейчас на грани истощения находятся разведанные запасы хрома, никеля, цинка, молибдена, олова, серебра, кадмия, ртути и других металлов.
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга (рис. 17), а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
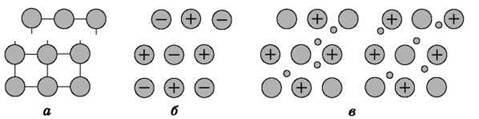
Рис. 17. Смещение слоев в атомной (а), ионной (б) и металлической (в) кристаллических решетках при механическом воздействии на твердые тела
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. Поэтому вещества с атомными и ионными кристаллическими решетками хрупкие.
- ЗАПОМНИ. По отношению к магнитному полю металлы подразделяются на ферромагнетики, которые сильно намагничиваются (железо, кобальт, никель, гадолиний), парамагнетики — слабо намагничиваются (щелочные, щелочноземельные и переходные металлы) и диамагнетики — выталкиваемые магнитным полем (медь, серебро, золото, висмут).
Наиболее пластичные металлы — это Au, Ag, Sn, Pb, Zn. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной 0,003 мм, а из 0,5 г этого металла можно вытянуть нить длиной 1 км.
Даже ртуть, которая при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь Bi и Mn, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и «медный» цвета.
Хотя на практике металл не всегда нам кажется «светлым телом». Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во- вторых, и чистый металл может не блестеть. Очень тонкие листки серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы (Li, K, Na, Rb, Cs), атомы которых имеют один валентный электрон, мягкие (режутся ножом), с небольшой плотностью (литий — самый легкий металл с ρ = 0,53 г/см3) и плавятся при невысоких температурах (например, температура плавления цезия 29 °С). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную -38,9 °С.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре (842 °С).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с s-орбиталей.
Самый тяжелый металл — это осмий Os с ρ = 22,5 г/см3 (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам W с tпл. = 3420 °С (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром Cr (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
При рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп (s- и р-элементы) и металлы побочных подгрупп (переходные d- и f-элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
1. Плотности — легкие (ρ < 5 г/см3) и тяжелые (все остальные).
2. Температуре плавления — легкоплавкие и тугоплавкие.
Железо и его сплавы принято считать черными металлами, а все остальные — цветными.
Существуют классификации металлов по химическим свойствам.
Металлы с низкой химической активностью называют благородными (серебро, золото, платина и ее аналоги — осмий, иридий, рутений, палладий, родий).
По близости химических свойств выделяют щелочные (металлы главной подгруппы I группы), щелочноземельные (кальций, стронций, барий, радий), а также редкоземельные металлы (скандий, иттрий, лантан и лантаноиды, актиний и актиноиды).
Общие химические свойства металлов
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы, то есть окисляются. В этом заключается главное общее свойство и атомов, и простых веществ — металлов.
- ЗАПОМНИ. Металлы в химических реакциях всегда восстановители.
Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ — металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д. И. Менделеева, изменяется закономерно.
Электрохимический ряд напряжений металлов
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.
Уменьшение восстановительных свойств:

Усиление окислительных свойств:
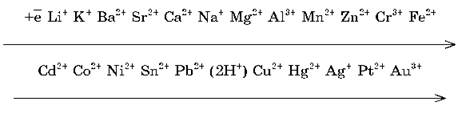
На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях (t = 25 °С, р = 1 атм).
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее).
3. Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе.
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой.
- ЗАПОМНИ. Металлы могут образовывать друг с другом химические соединения, которые называют интерметаллическими соединениями. Они обладают металлической связью и не имеют постоянного состава.
Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов.
Например, литий более активен в водных растворах, чем натрий (хотя по положению в периодической системе Na — более активный металл). Дело в том, что энергия гидратации ионовLi+ значительно больше, чем энергия гидратации Na+, поэтому первый процесс является энергетически более выгодным.
Рассмотрев общие положения, характеризующие восстановительные свойства металлов, перейдем к конкретным химическим реакциям.
Взаимодействие металлов с неметаллами
1. С кислородом большинство металлов образуют оксиды — основные и амфотерные. Кислотные оксиды переходных металлов, например оксид хрома (VI) CrO3 или оксид марганца (VII)Mn2O7, не образуются при прямом окислении металла кислородом. Их получают косвенным путем.
Щелочные металлы Na, K активно реагируют с кислородом воздуха, образуя пероксиды:
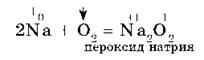
Оксид натрия получают косвенным путем, при прокаливании пероксидов с соответствующими металлами:
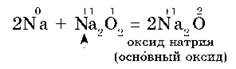
Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды:
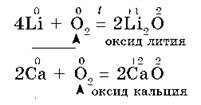
Другие металлы, кроме золота и платиновых металлов, которые вообще не окисляются кислородом воздуха, взаимодействуют с ним менее активно или при нагревании:
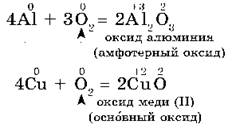
2. С галогенами металлы образуют соли галогеноводородных кислот, например:
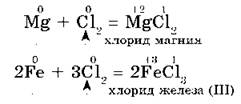
3. С водородом самые активные металлы образуют гидриды — ионные солеподобные вещества, в которых водород имеет степень окисления —1, например:
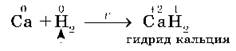
Многие переходные металлы образуют с водородом гидриды особого типа — происходит как бы растворение или внедрение водорода в кристаллическую решетку металлов между атомами и ионами, при этом металл сохраняет свой внешний вид, но увеличивается в объеме. Поглощенный водород находится в металле, по- видимому, в атомарном виде.
Существуют и гидриды металлов промежуточного характера.
- ЗАПОМНИ. В ходе взаимодействия металлов с неметаллами образуются оксиды основные и амфотерные, соли галогеноводородных кислот, гидриды, сульфиды, нитриды.
4. С серой металлы образуют соли — сульфиды, например:
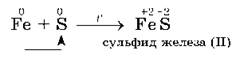
5. С азотом металлы реагируют несколько труднее, т. к. химическая связь в молекуле азота N2 очень прочна; при этом образуются нитриды. При обычной температуре взаимодействует с азотом только литий:
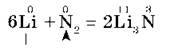
Взаимодействие металлов со сложными веществами
1. С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания — щелочи, например:
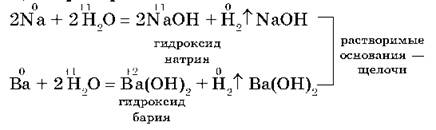
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку:
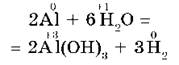
- ЗАПОМНИ. В ходе взаимодействия металлов с водой образуются растворимые основания — щелочи; с кислотами в растворе — соль и вода; с солями менее активных металлов в растворе выделяется менее активный металл в свободном виде.
Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:
![]()
Если горящий магний внести в воду, то горение продолжается, т. к. протекает реакция:
2H2 + O2 = 2H2O (горит водород)
Железо взаимодействует с водой только в раскаленном виде:
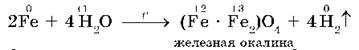
2. С кислотами в растворе (HCl, H2SO4(разб.), CH3COOH и др., кроме HNO3) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород.
Например:
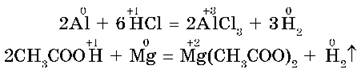
А вот свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, т. к. образующийся сульфат свинца PbSO4 нерастворим и создает на поверхности металла защитную пленку.
3. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде.
Например:
![]()
Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучал Н. Н. Бекетов — великий русский ученый в области физической химии. Он расположил металлы по химической активности в «вытеснительный ряд», ставший прототипом ряда напряжений металлов.
4. С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами:
![]()
Аналогично реагирует и фенол:
![]()
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):
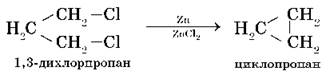
(технический метод получения циклопропана)
![]()
5. Со щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны.
Например:
![]()
6. Металлы могут образовывать друг с другом химические соединения, которые получили общее название интерметаллических соединений. В них чаще всего не проявляются степени окисления атомов, которые характерны для соединений металлов с неметаллами. Например:
Cu3Au, LaNi5, Na2Sb, Ca3Sb2 и др.
Интерметаллические соединения обычно не имеют постоянного состава, химическая связь в них в основном металлическая. Образование этих соединений более характерно для металлов побочных подгрупп.