Химия - Универсальный справочник школьника подготовка к ЕГЭ
Железо - Характеристика переходных элементов — меди, цинка, хрома, железа - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Строение и свойства атомов
Железо Fe — элемент побочной подгруппы VIII группы и 4-го периода периодической системы Д. И. Менделеева. Атомы железа устроены несколько отлично от атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется из них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 элементов. Следовательно, распределение электронов по уровням в атомах железа таково: 2ē; 8ē; 14ē; 2ē.

Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня, и приобретая степень окисления +2, но и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
- ЗАПОМНИ. Природные минералы железа: магнитный железняк (магнетит) Fe2O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 · 3H2O.
Железо — простое вещество
Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться. Ему можно придать большую прочность и твердость методами термического и механического воздействия.
- ЗАПОМНИ. Железо играет важную роль в жизни живых организмов:
· является основным катализатором дыхательных процессов;
· входит в состав гемоглобина крови;
· участвует в процессе переноса кислорода от органов дыхания к тканям.
Ежедневная потребность человека в железе составляет 5-10 мг.
Различают технически чистое и химически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02-0,04 % углерода, а кислорода, серы, азота и фосфора — еще меньше. Химически чистое железо содержит менее 0,01 % примесей. Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии.
В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы, и заканчивая космическими аппаратами, не может быть изготовлено без применения железа.
Химические свойства железа
Железо может проявлять степени окисления +2 и +3, соответственно, железо дает два ряда соединений. Число электронов, которое атом железа отдает при химических реакциях, зависит от окислительной способности реагирующих с ним веществ.
Например, с галогенами железо образует галогениды, в которых оно имеет степень окисления +3:
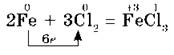
а с серой — сульфид железа (II):
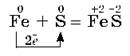
Раскаленное железо сгорает в кислороде с образованием железной окалины:
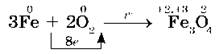
При высокой температуре (700-900 °С) железо реагирует с парами воды:
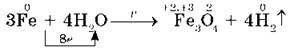
В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснить металлы, стоящие правее него, из водных растворов их солей, например:
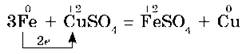
В разбавленных соляной и серной кислотах железо растворяется, т. е. окисляется ионами водорода:
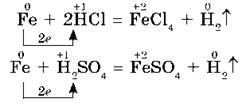
Растворяется железо и в разбавленной азотной кислоте, при этом образуется нитрат железа (III), вода и продукты восстановления азотной кислоты — N2, NO или NH3(NH4NO3) в зависимости от концентрации кислоты.
Соединения железа
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 · 3H2O.
Еще одно природное соединение железа — железный, или серный, колчедан (пирит) FeS2, не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Для железа характерны два ряда соединений: соединения железа (II) и железа (III).
Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 получают косвенно, в частности, по следующей цепи превращений:
![]()
Оба соединения имеют ярко выраженные основные свойства.
Катионы железа (II) Fe2+ легко окисляются кислородом воздуха до катионов железа (III) Fe3+. Поэтому белый осадок гидроксида железа (II) приобретает зеленую окраску, а затем становится бурым, превращаясь в гидроксид железа (III):
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Оксид железа (III) Fe2O3 и соответствующий ему гидроксид железа (III) Fe(OH)3 также получают косвенно, например, по цепочке:
![]()
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа (II) FeSO4 · 7H2O, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок и в других целях. Хлорид железа (III) FeCl3 используют в качестве протравы при крашении тканей. Сульфат железа (III) Fe2(SO4)3 · 9H2O применяется для очистки воды и в других целях.
Физические и химические свойства железа и его соединений обобщены в табл. 11.
Таблица 11
Железо и его соединения
|
Железо |
Оксиды железа (II) и (III) |
Гидроксиды железа (II) и (III) |
|
1. Серебристо-белый металл. 2. Взаимодействует с простыми веществами: а) горит в кислороде: 3Fe + 2O2 = Fe3O4 б) реагирует с хлором: 2Fe + 3Сl2 = 2FeCl3 в) взаимодействует с серой: Fe + S = FeS 3. Реагирует с растворами кислот:
4. Вытесняет водород из воды при сильном нагревании:
5. Окисляется в присутствии воды и кислорода воздуха (с образованием ржавчины): 4Fe + 6Н2O + 3O2 = 4Fe(OH)3 6. Замещает менее активный металл в растворе его соли: Fe + Cu2+ = Fe2+ + Сu Получение: восстановление оксидов железа оксидом углерода(II), водородом или алюминием: Fe3O4 + 4СO = 3Fe + 4СO2 FeO + Н2 = Fe + Н2O Fe2O3 + 2Аl = 2Fe + Аl203 |
1. Проявляют основные свойства, взаимодействуя с кислотами: FeO + 2Н+ = Fe2+ + Н2O; Fe2O3 + 6H+ = 2Fe3+ + 3H2O 2. Оксид железа (III) проявляет слабые амфотерные свойства, взаимодействуя при нагревании с основными оксидами с образованием ферритов: MnO + Fe2O3 = Mn(FeO2)2 |
1. Проявляют свойства нерастворимых в воде оснований: а) взаимодействуют с кислотами:
б) разлагаются при нагревании: Fe(OH)2 = FeO + Н2O 2Fe(OH)3 = Fe2O3 + 3H2O 2. Гидроксид железа (III) проявляет слабые амфотерные свойства, реагируя с горячими концентрированными растворами щелочей: Fe(OH)3 + NaOH = NaFeO2 + 2Н2O 3. Гидроксид железа (II) на воздухе окисляется в гидроксид железа (III): 4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3 4. Соли железа (II) и (III) гидролизуются:
|
Качественные реакции на ионы Fe2+ и Fe3+
Для распознавания соединений железа (II) и (III) проводят качественные реакции на ионы Fe2+ и Fe3+. Качественной реакцией на ионы Fe2+ служит реакция солей железа (II) с соединением ![]() называемым красной кровяной солью. Это особая группа солей, которые называются комплексными, с ними вы познакомитесь в дальнейшем. Пока же нужно усвоить, как диссоциируют такие соли:
называемым красной кровяной солью. Это особая группа солей, которые называются комплексными, с ними вы познакомитесь в дальнейшем. Пока же нужно усвоить, как диссоциируют такие соли:
![]()
Реактивом на ионы Fe3+ является другое комплексное соединение — желтая кровяная соль — ![]() которая в растворе диссоциирует аналогично:
которая в растворе диссоциирует аналогично:
![]()
Если в растворы, содержащие ионы Fe2+ и Fe3+, добавить, соответственно, растворы красной кровяной соли (реактив на Fe2+) и желтой кровяной соли (реактив на Fe3+), то в обоих случаях выпадает одинаковый синий осадок:
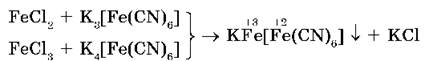
Для обнаружения ионов Fe3+ еще используют взаимодействие солей железа (III) с роданидом калия KNCS или аммония NH4NCS. При этом образуется ярко окрашенный ион FeNCNS2+, в результате чего весь раствор приобретает интенсивно красный цвет:
![]()
Роль железа в жизнедеятельности живых организмов
Роль железа очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и биологическим тканям.
Окраску крови придают именно соединения железа. Если лишить железа растения и животных, то они изменят свою окраску. Как человек бледнеет, когда не хватает гемоглобина в крови, так и растение, растущее при недостатке железа в почве, будет бледным или даже бесцветным. Поэтому соединения железа издавна применяются для лечения малокровия, при истощении, упадке сил.
Для человека и животных источником железа служат растения. В зеленых овощах, таких как шпинат, салат, капуста, железа много. Чем интенсивнее окрашены растения и животные, тем больше в них железа. Так, розовая вишня содержит наполовину меньше железа, чем черная. Светло-зеленый капустный лист в шесть раз беднее железом, чем зеленый. В говядине железа больше, чем в телятине.