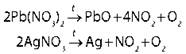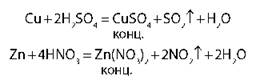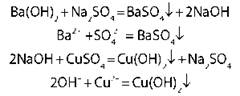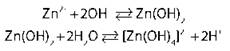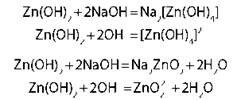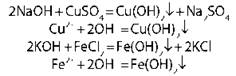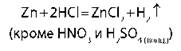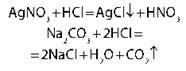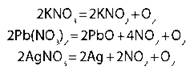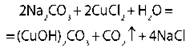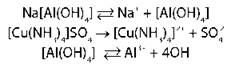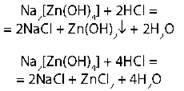Химия - Универсальный справочник школьника подготовка к ЕГЭ
ЭКСПРЕСС-ПОМОЩНИК - Урок 3 - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Классификация и номенклатура неорганических веществ
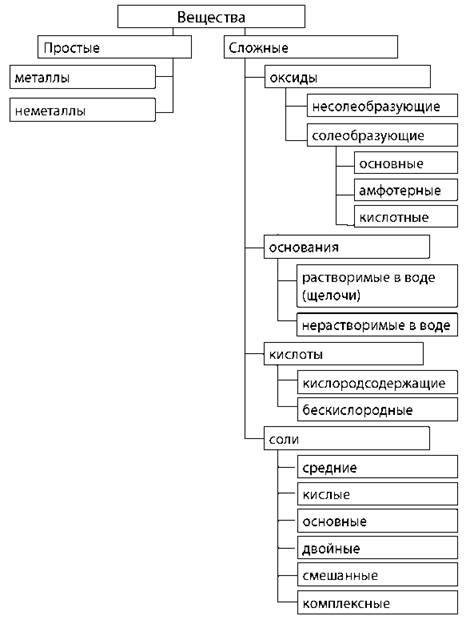
Химические свойства оксидов
|
Основные |
Кислотные |
Амфотерные |
|
1. Взаимодействие с водой |
||
|
Образуют щелочи K2O + H2O = 2KOH |
Большинство образует кислоты SO3 + H2O = H2SO4 |
Не взаимодействуют |
|
2. Взаимодействие с кислотами |
||
|
Образуют соль и воду CuO + 2HCl = CuCl2 + H2O |
Не взаимодействуют |
Образуют соль и воду ZnO + 2HCl = ZnCl2 + H2O |
|
3. Взаимодействие с основаниями |
||
|
Не взаимодействуют |
Образуют соль и воду CO2 + 2NaOH = Na2CO3 + H2O |
Образуют соль ZnO + 2NaOH + H2O = Na2[Zn(OH)4] |
|
4. Взаимодействие между собой |
||
|
Реагируют между собой с образованием соли CaO + CO2 = CaCO3 |
|
|
Получение оксидов
|
Способы |
Химические реакции |
|
Окисление простых веществ |
2Mg + O2 = 2MgO C + O2 = CO2 |
|
Окисление сложных веществ |
2H2S + 3O2 = 2H2O + 2SO2 |
|
Разложение солей |
! Кроме карбонатов щелочных металлов
|
|
Разложение оснований |
! Щелочи не разлагаются |
|
Взаимодействие кислот-окислителей с металлами и некоторыми неметаллами |
|
Химические свойства оснований
|
Щелочи |
Нерастворимые основания |
|
1. Взаимодействие с кислотами (реакция нейтрализации) |
|
|
NaOH + HCl = NaCl + H2O H- + H+ = H2O |
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O Cu(OH)2 + 2H+ = Cu2+ + 2H2O |
|
2. Взаимодействие с кислотными оксидами |
|
|
2KOH + CO2 = K2CO3 + H2O 2OH- + CO2 = CO32- + H2O |
Не взаимодействуют |
|
3. Взаимодействие с амфотерными оксидами |
|
|
|
Не взаимодействуют |
|
4. Взаимодействие с растворами солей |
|
|
с образованием осадка
|
Не взаимодействуют |
|
5. Термическое разложение |
|
|
не разлагаются |
Образуются соответствующий оксид и вода
|
Амфотерные гидроксиды Al(OH)3, Zn(OH)2, Cr(OH)3
|
Виды взаимодействий |
Химические реакции |
|
Диссоциация в водном растворе с образованием катионов водорода H+и гидроксид-ионы OH- |
|
|
С кислотами |
|
|
Со щелочами: · в растворе · при сплавлении |
|
Получение гидроксидов
|
Способы |
Химические реакции |
|
Щелочи |
|
|
Металл + вода |
|
|
Оксид металла + вода |
Li2O + H2O = 2LiOH CaO + H2O = Ca(OH)2 |
|
Электролиз водных растворов солей щелочных металлов |
|
|
Нерастворимые основания |
|
|
Щелочь + раствор соли |
|
Химические свойства кислот pH < 7
|
Виды взаимодействий |
Химические реакции |
|
Растворы изменяют окраску индикаторов |
Лакмус → красный метиловый оранжевый → розовый |
|
Взаимодействуют с металлами, стоящими в ряду напряжения до водорода |
|
|
Взаимодействуют с основными и амфотерными оксидами |
CuO + 2HCl = CuCl2 + H2O |
|
Взаимодействуют с основаниями (реакция нейтрализации) |
Fe(OH)2 + 2HCl = FeCl2+2H2O |
|
Взаимодействуют с солями, если образуется малорастворимая соль или летучее соединение |
|
Получение кислот
|
Виды взаимодействий |
Химические реакции |
|
Прямое взаимодействие водорода с неметаллом с дальнейшим растворением в воде |
|
|
Кислотный оксид + H2O |
SO3 + H2O = H2SO4 |
|
Неметалл + сильный окислитель (для некоторых кислот) |
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO |
|
Соль + менее летучая кислота |
|
|
Прямое взаимодействие водорода с неметаллом с дальнейшим растворением в воде |
|
|
Кислотный оксид + H2O |
SO3 + H2O = H2SO4 |
|
Неметалл + сильный окислитель (для некоторых кислот) |
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO |
|
Соль + менее летучая кислота |
|
Соли
|
Классификация |
Состав |
|
Средние |
Результат полного замещения атомов водорода кислоты атомами металла или группы OH основания кислотным остатком
|
|
Кислые |
Результат неполного замещения атомов водорода кислоты атомами металла
|
|
Основные |
Результат неполного замещения гидроксогрупп основания кислотными остатками
|
|
Двойные |
Состоят из ионов двух металлов и одного кислотного остатка
|
|
Смешанные |
Состоят из ионов одного металла и двух кислотных остатков
|
|
Комплексные |
В состав входят сложные (комплексные) ионы
|
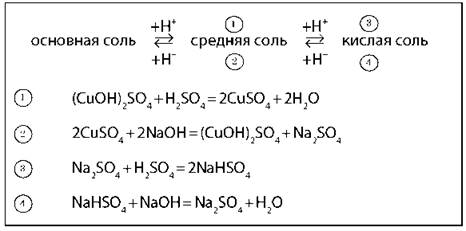
Общая схема взаимопревращений солей
Химические свойства средних солей
|
Виды взаимодействий |
Химические реакции |
|
|
Взаимодействие с металлами |
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg |
|
|
Взаимодействие с щелочами |
|
ионные реакции, один из продуктов должен быть удален |
|
Взаимодействие с кислотами |
|
|
|
Взаимодействие растворов солей |
|
|
|
Некоторые распадаются при прокаливании |
||
|
Карбонаты (кроме карбонатов щелочных металлов) |
CaCO3 = CaO + CO2 |
|
|
Нитраты (в зависимости от положения металла в ряду стандартных электродных потенциалов) |
|
|
|
Кислые соли |
|
|
|
Основные соли |
|
|
|
Кислые и основные соли обладают всеми общими химическими свойствами солей Кислые соли растворяются лучше, а основные — хуже соответствующих средних солей |
||
Получение солей
|
Способы |
Химические реакции |
|
Средние соли |
|
|
Из металлов |
|
|
металл с неметаллом |
2Mg + Cl2 = MgCl2 |
|
металл с кислотой |
|
|
металл с солью |
Cu + HgCl2 = CuCl2 + Hg |
|
Из оксидов |
|
|
основные оксиды с кислотами |
CaO + 2HCl = CaCl2 + H2O |
|
кислотные оксиды с щелочами |
CO2 + Ca(OH)2 = CaCO3 + H2O |
|
кислотные оксиды с основными |
CaO + CO2 = CaCO3 |
|
Реакция нейтрализации |
|
|
кислота с основанием |
H2SO4 + 2NaOH = Na2SO4 + 2H2O |
|
Из солей |
|
|
соли с солями |
|
|
соли со щелочами |
|
|
соли с кислотами |
|
|
Кислые соли |
|
|
Получают таким же способом, как и средние, но при других молярных соотношениях реагентов |
2NaOH + H2SO4 = Na2SO4 + 2H2O 2NaOH + CO2 = Na2CO3 + H2O 2 : 1 — средняя NaOH + H2SO4 = NaHSO4 + H2O NaOH + CO2 = NaHCO3 1 : 1 — кислая |
|
Основные соли |
|
|
Средних солей со щелочами |
2CuSO4 + 2NaOH = (CuOH)2SO4 + Na2SO4 К раствору соли приливают раствор щелочи, а не наоборот |
|
При взаимодействии средних солей, одна из которых образована сильным основанием и слабой кислотой, а другая — слабым основанием и сильной кислотой |
|
Классификация солей
|
Принципы классификации |
Примеры |
|
По знаку электрического заряда комплексного иона |
катионные [Cu(NH3)4]2+SO4 |
|
анионные K2[PtCl4]2- |
|
|
катионно-анионные [Co(NH3)6]3+[Fe(CN)6]3- |
|
|
нейтральные [Ni(CO)4]0 |
|
|
По природе лигандов |
гидроксокомплексы Na2[Al(OH)4] |
|
аквакомплексы [Cr(H2O)6]Cl3 |
|
|
ацидокомплексы K4[Fe(CN)6] |
|
|
аминокислоты [Ag(NH3)2]Cl |
|
|
смешанные комплексы Na[Al(OH)4(H2O)2] |
Строение солей
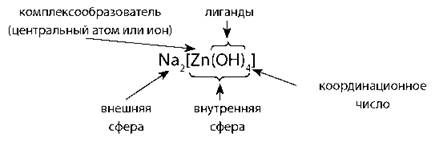
Существуют комплексы без внешней сферы ([Ni(CO)4]) или комплексы, в которых и внешняя, и внутренняя сферы представлены комплексными ионами ([Co(NH3)6][Fe(CN)6])
Химические свойства солей
|
Виды взаимодействий |
Химические реакции |
|
Диссоциация: · первичная — по типу сильных электролитов · вторичная (диссоциация комплексного иона) — по типу слабых электролитов, кроме нейтральных комплексов |
|
|
Термическое разложение |
|
|
Реакции, в которых образуются более устойчивые комплексы |
|
|
Реакции с кислотами: · в небольшом количестве кислоты · в избытке кислоты |
|
|
Реакции разрушения комплекса |
|
Аллотропия фосфора
|
Характеристика |
Аллотропные модификации |
||
|
Белый фосфор |
Красный фосфор |
Черный фосфор |
|
|
Кристаллическая решетка |
молекулярная Р4 |
атомная |
атомная |
|
Цвет |
белый |
от красного до фиолетового |
серо-черный |
|
Запах |
чеснока |
нет |
нет |
|
Твердость |
воскоподобный |
твердый |
Относительно мягкий |
|
Температура плавления, tпл |
44 °С |
плавится только под давлением, при t > 280 °С переходит в пары белого фосфора |
|
|
Растворимость |
слабо в H2O, хорошо в CS2 |
нерастворимый |
|
|
Реакционная способность |
высокая |
низкая |
средняя |
|
Люминесценция |
зеленоватое свечение |
нет |
нет |
Аллотропия углерода
|
Аллотрапные модификации |
Характеристики вещества |
|
Алмаз
|
• sр3-гибридизация атома C • прочные ковалентные связи • неметалл • атомная кристаллическая решетка • прозрачные кристаллы • имеет самую большую твердость среди природных соединений • изолятор |
|
Графит
|
• sр2-гибридизация атома C • слоистая структура • атомная кристаллическая решетка • серого цвета • мягкий • имеет высокую электропроводность |
|
Карбон |
-C → C-C → C- |
|
Поликумулен |
=C=C=C=C= |
|
Фуллерены |
C60 и C70 — полые сферы, напоминающие футбольные мячи, поверхность которых образована пяти- и шестиугольниками из атомов углерода |