Химия - Универсальный справочник школьника подготовка к ЕГЭ
Растворы - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Классификация растворов
Раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворы подразделяются на:
· молекулярные — водные растворы неэлектролитов — органических веществ (спирт, глюкоза и т. д.);
· молекулярно-ионные — растворы слабых электролитов (азотистой, сероводородной кислот и др.);
· ионные — растворы сильных электролитов (щелочей, солей, кислот — NaOH, K2SO4, HNO3). Растворы бывают концентрированными и разбавленными. Из практического опыта известно, что растворимость многих веществ небезгранична и зависит от температуры.
Насыщенным называется такой раствор, в котором при данной температуре вещество больше не растворяется.
В ненасыщенном растворе содержится меньше вещества, а в перенасыщенном — больше, чем в насыщенном.
В работе с веществами важно знать их растворимость в воде. Вещество считается хорошо растворимым, если при комнатной температуре в 100 г воды растворяется 1 г этого вещества; если меньше, то вещество считается малорастворимым; при растворимости менее 0,001 г — нерастворимым.
Поведение веществ в растворе
Растворение — это физико-химический процесс. Он сочетает в себе физический процесс (дробление до молекул) и химическое воздействие компонентов (образование в воде непрочных соединений — гидратов).
В процессе растворения молекулы воды разрушают кристаллы растворяемого вещества. Это разрушение происходит в месте соприкосновения кристалла с водой. Чем больше площадь поверхности соприкосновения, тем быстрее разрушаются кристаллы. В результате диффузии происходит самопроизвольное распределение частиц одного вещества между частицами другого, что приводит к образованию раствора. Для улучшения контакта вещества с растворителем увеличивают площадь поверхности соприкосновения, вещества измельчают и раствор перемешивают.
В результате химического взаимодействия вещества с водой образуются соединения — гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как тепловые явления при растворении: растворение H2SO4 сопровождается выделением тепла, растворение NaCl, NH4, NO — охлаждением. Косвенным доказательством гидратации является существование твердых кристаллогидратов — солей, в состав которых входят вода, например медный купорос CuSO4 х 5H2O.
- ЗАПОМНИ
![]()
ω — массовая доля вещества, m — масса растворенного вещества, mр — масса раствора
![]()
Массовая доля вещества. Концентрация растворов
Массовая доля растворенного вещества — это отношение его массы m к массе раствора mр. Ее обозначают буквой ω («омега»).
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой φ («фи»).
Концентрация (С) — это содержание растворенного вещества в единице массы или объема.
Процентная концентрация раствора — это отношение массы растворенного вещества m (в граммах) к массе раствора (в граммах).
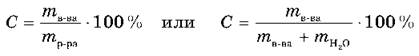
Молярная концентрация — это отношение количества растворенного вещества n (в молях) к объему раствора V (в литрах). Ее обозначают буквой С.