Химия - Универсальный справочник школьника подготовка к ЕГЭ
Бензол - Ароматические углеводороды. Бензол, его электронное строение, свойства. Гомологи бензола (толуол) - ОРГАНИЧЕСКАЯ ХИМИЯ
Ароматические углеводороды — соединения углерода и водорода, в молекуле которых имеется бензольное кольцо. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи — продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
Строение молекулы бензола
Первое ароматическое соединение — бензол — было открыто в 1825 г. М. Фарадеем. Была установлена его молекулярная формула — C6H6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (C6H14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле углеводорода приводит появление кратных связей и циклов. В 1865 г. Ф. Кекуле предложил его структурную формулу как циклогексантриена-1,3,5.
Таким образом, молекула, соответствующая формуле Кекуле, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.
Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к предельным углеводородам.
- ЗАПОМНИ
Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензола. Окончательно строение молекулы бензола было подтверждено реакцией его образования из ацетилена. В действительности углерод-углеродные связи в бензоле равноценны, и их свойства не похожи на свойства ни одинарных, ни двойных связей.
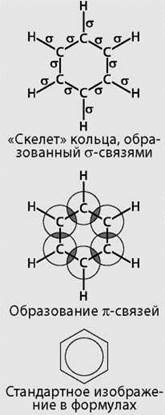
В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность.
![]()
Так в чем же особенность структуры бензола?
На основании данных исследований и расчетов сделан вывод о том, что все шесть углеродных атомов находятся в состоянии sр2-гибридизации и лежат в одной плоскости. Негибридизованные р-орбитали атомов углерода, составляющие двойные связи (формула Кекуле), перпендикулярны плоскости кольца и параллельны друг другу.
Они перекрываются между собой, образуя единую π-систему. Таким образом, система чередующихся двойных связей, изображенных в формуле Кекуле, является циклической системой сопряженных, перекрывающихся между собой л-связей. Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Так, изображать бензол в виде правильного шестиугольника с окружностью в центре (π-система) более логично, чем в виде циклогексантриена-1,3,5.
Американский ученый Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга:
![]()
т. е. считать его промежуточным соединением, «усреднением» двух структур.
Данные измерений длин связей подтверждают это предположение. Выяснено, что все связи С—С в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С связей (0,154 нм) и длиннее двойных (0,132 нм).
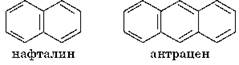
Существуют также соединения, молекулы которых содержат несколько циклических структур, например:
Изомерия и номенклатура
Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метилбензол) — не имеет таких изомеров; следующий гомолог представлен в виде четырех изомеров:
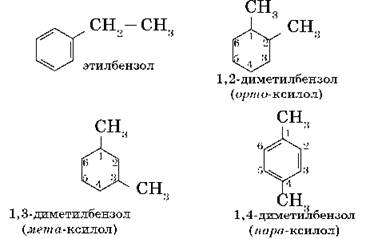
Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:
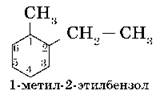
Если заместители одинаковые, то нумерацию проводят по самому короткому пути: например, вещество:
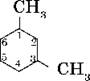
называется 1,3-диметилбензол, а не 1,5-диметилбензол.
По старой номенклатуре положения 2 и 6 называют ортоположениями, 4 — пара-, 3 и 5 — метаположениями.
Физические свойства
Бензол и его простейшие гомологи в обычных условиях — весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.
Химические свойства
Реакции замещения. Ароматические углеводороды вступают в реакции замещения.
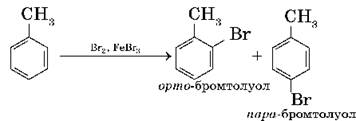
1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа (III), один из атомов водорода в бензольном кольце может замещаться на атом брома:
2. Нитрование бензола и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу — NO2:
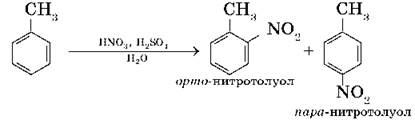
Восстановлением нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей:
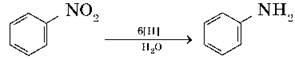
Эта реакция носит имя русского химика Зинина.
Реакции присоединения. Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан и его производные.
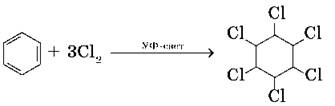
1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов:
![]()
2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободно-радикальной: Cl