Химия - Универсальный справочник школьника подготовка к ЕГЭ
Электронное строение функциональных групп кислородсодержащих органических веществ (КОВ) - ОРГАНИЧЕСКАЯ ХИМИЯ
Функциональными группами называются группы атомов, которые обуславливают характерные химические свойства данного класса веществ.
- ЗАПОМНИ. Электронная формула этилового спирта:
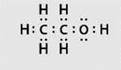
Строение молекул спиртов R—OH. Атом кислорода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. В молекулах спиртов имеются полярные связи C—O и O—H.
![]()
Учитывая полярность связи O—H и значительный положительный заряд на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал. Атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность молекулам спирта образовывать водородные связи.
- ЗАПОМНИ.
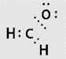
Электронная формула формальдегида и его строение
По химическим свойствам фенолы отличаются от спиртов, что вызвано взаимным влиянием в молекуле фенола гидроксильной группы и бензольного ядра (фенил — С6Н5). Это влияние сводится к тому, что π-электроны бензольного ядра частично вовлекают в свою сферу неподеленные электронные пары атома кислорода гидроксильной группы, в результате чего уменьшается электронная плотность у атома кислорода. Это снижение компенсируется за счет большей поляризации связи О—Н, что в свою очередь приводит к увеличению положительного заряда на атоме водорода:
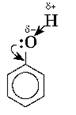
Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер.
Влияние атомов в молекулах фенола и его производных взаимно. Гидроксильная группа оказывает влияние на плотность π-электронного облака в бензольном кольце. Она понижается у атома углерода, связанного с ОН-группой (т. е. у 1-го и 3-го атомов углерода, метаположение) и повышается у соседних атомов углерода — 2, 4, 6-го — орто- и параположения.
Водородные атомы бензола в орто- и параположениях становятся более подвижными и легко замещаются на другие атомы и радикалы.
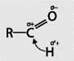
Альдегиды имеют общую формулу ![]() где
где ![]() карбонильная группа. Атом углерода в карбонильной группе sр3-гибридизорован. Атомы, непосредственно с ним связанные, находятся в одной плоскости. Вследствие большой электроотрицательности атома кислорода по сравнению с углеродным атомом связь C=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:
карбонильная группа. Атом углерода в карбонильной группе sр3-гибридизорован. Атомы, непосредственно с ним связанные, находятся в одной плоскости. Вследствие большой электроотрицательности атома кислорода по сравнению с углеродным атомом связь C=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:
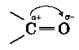
Под влиянием карбонильного атома углерода в альдегидах увеличивается полярность связи C—H, что повышает реакционноспособность этого атома H.
Карбоновые кислоты содержат функциональную группу 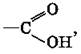 называемую карбоксильной группой, или карбоксилом. Так она названа потому, что состоит из карбонильной группы —
называемую карбоксильной группой, или карбоксилом. Так она названа потому, что состоит из карбонильной группы — ![]() и гидроксильной —OH.
и гидроксильной —OH.
- ЗАПОМНИ. Строение односоставной предельной карбоновой кислоты:
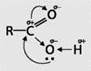
В карбоновых кислотах гидроксильная группа связана с углеводородным радикалом и карбонильной группой. Ослабление связи между кислородом и водородом в гидроксильной группе объясняется разностью электроотрицательностей атомов углерода, кислорода и водорода. Атом углерода приобретает некоторый положительный заряд. Этот атом углерода притягивает к себе электронное облако от атома кислорода гидроксильной группы. Компенсируя смещенную электронную плотность, атом кислорода гидроксильной группы оттягивает к себе электронное облако соседнего атома водорода. Связь O—H в гидроксильной группе становится более полярной, и атом водорода приобретает большую подвижность.