Физика - Поурочные планы к учебникам Г. Я. Мякишева, С. В. Громова и В. Л. Касьянова 10 класс
Уравнение Клапейрона-Менделеева - МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
Цель: вывести уравнение Клапейрона-Менделеева и научить решать задачи по этой формуле.
Ход урока
I. Проверка домашнего задания. Повторение изученного
1. Почему барабанная перепонка уха не продавливается бомбардирующими- ее молекулами воздуха?
2. Что доказал эксперимент О. фон Герике?
3. Сформулируйте и запишите основное уравнение молекулярно-кинетической теории.
4. Сформулируйте закон Дальтона.
5. На высоте порядка сотен километров над Землей молекулы атмосферы имеют кинетическую энергию, которой соответствует температура порядка тысяч градусов Цельсия. Почему на такой высоте не плавятся искусственные спутники Земли?
II. Самостоятельная работа
Вариант 1
1. В сосуде вместимостью 5 · 10-3 м3 находится водород массой 1 кг под давлением 2 · 105 Па. Чему равна средняя кинетическая энергия поступательного движения молекул?
2. В баллоне вместимостью 5 · 10-3 м3 находится 1 моль газа. Какова концентрация молекул в баллоне? Рассчитайте концентрацию молекул в баллоне, если в нем осталась половина массы газа.
3. Изменится ли давление идеального газа на стенки сосуда, если концентрация его молекул уменьшится в четыре раза, а средняя квадратичная скорость молекул увеличится в четыре раза? Ответ обоснуйте.
4. Средняя квадратичная скорость молекул метана при нормальном атмосферном давлении равна 651 м/с. Какова концентрация молекул метана? Масса молекулы метана равна 26,6 · 10-27 кг.
Вариант 2
1. Кислород массой 0,32 кг занимает объем 2 · 10-3 м3. Рассчитайте концентрацию молекул.
2. Рассчитайте давление, оказываемое молекулами азота на стенки сосуда, если средний квадрат скорости движения его молекул v2 = 0,5 · 106 м2/с2. Плотность азота равна 1,25 кг/м3.
3. Температура газа 30 °С. Концентрация молекул 1025 м-3. Под каким давлением находится газ?
4. Масса молекулы озона равна 80 · 1027 кг. Рассчитайте среднюю квадратичную скорость молекул этого газ при 29 °С.
5. Можно ли говорить о концентрации применительно к одной молекуле?
6. Можно ли говорить о температуре одной или нескольких молекул?
Ответ:
Вариант 1: 1. 5 · 10-24 Дж. 2. ≈ 2,7 · 1025 м3. 3. Р2 = 4P1. 4. ≈ 2,7 · 1024 м-3
Вариант 2: 1. 3 · 1027 м-3. 2. 2 · 105 Па. 3. ≈ 4 · 104 Па. 4. 394 м/с
III. Изучение нового материала
В 1834 г. французский физик Б. Клапейрон, работавший длительное время в России (Петербурге), вывел уравнение состояния идеального газа при постоянной массе газа (m = const).
Из уравнения ![]() и основного уравнения MKT
и основного уравнения MKT ![]()
Зная, что ![]() получим
получим ![]()
Это уравнение связывает давление, объем и температуру, которые определяют состояние идеального газа, и называется уравнением состояния идеального газа.
Для постоянной массы идеального газа отношение произведения давления на объем к данной температуре есть величина постоянная.
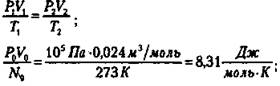
Для одного моля газа при нормальных условиях.
![]() - универсальная газовая постоянная,
- универсальная газовая постоянная,
В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул.
![]() где NA - число Авогадро, k - постоянная Больцмана.
где NA - число Авогадро, k - постоянная Больцмана. ![]()
![]() - уравнение Менделеева-Клапейрона.
- уравнение Менделеева-Клапейрона.
IV. Закрепление изученного
1. Что называют уравнением состояния системы?
2. Выведите уравнение Клапейрона-Менделеева для произвольной массы идеального газа.
3. Чему равна универсальная газовая постоянная в СИ?
4. Как запишется уравнение состояния для одного моля?
5. Чему равен объем одного моля любого газа при нормальных условиях?
6. Как физический смысл универсальной газовой постоянной?
V. Решение задач
1. В сосуде вместимостью 500 см3 содержится 0,89 г водорода при температуре 17 °С. Определите давление газа.
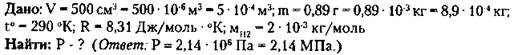
2. В баллоне емкостью 25,6 л находится 1,04 кг азота при давлении 3,5 МПа. Определить температуру газа.
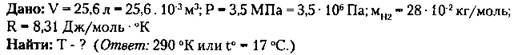
3. Какой объем занимает газ в количестве 103 моль при давлении 1 МПа и температуре 100 °С? (Ответ: V ≈ 3,1 м3).
4. Найти плотность водорода при температуре 15 °С и давлении 98 кПа. (Ответ: с = 0,082 кг/м3).
5. При какой температуре 1 см3 газа содержит 1019 молекул, если давление газа равно 104 Па? (Ответ: Т = 72 °К).
6. В баллоне вместимостью 0,05 м3 находится газ, взятый в количестве 0,12 · 103 моль при давлении 6 · 106 Па. Определите среднюю кинетическую энергию теплового движения молекулы газа. (Ответ: Е ≈ 6,2 · 10-21 Дж).
7. При нормальных условиях масса газа 738,6 мг, а объем 8,205 л. Какой это газ?
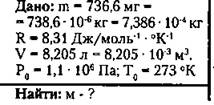
Решение:
Пользуясь периодической системой химических элементов Менделеева, определяем, что данную молярную массу имеет водород (Н2).
(Ответ: этот газ - водород.)
8. Газ при давлении 8,1 · 105 Па и температуре 12 °С занимает объем 855 л. Каким будет давление, если та же масса газа при температуре 320 °К займет объем 800 л? (Ответ: Р2 = 9,72 · 105 Па.)
9. Объем газа при давлении 7,2.105 Па и температуре 288 °К равен 0,6 м3. При какой температуре масса газа займет объем 1,6 м3, если давление станет равным 2,25 · 105 Па? (Ответ: Т2= 240 °К.)
10. Газ при давлении 3,2 · 104 Па и температуре 290 °К занимает объем 87 л. Найти объем газа при нормальных условиях. (Нормальные условия: р0 = 1,01 · 105 Па; Т0 = 273 °К.) ( Ответ:V2 = 26 л.)
11. Перед тактом сжатия давление смеси в цилиндре двигателя внутреннего сгорания равно 0,8 · 105 Па, а температура 50 °С. Определите температуру смеси в конце такта сжатия, если объем смеси в процессе сжатия уменьшился в 5 раз, а давление увеличилось до 7 · 105 Па. (Ответ: Т2 ≈ 320 °К).
Домашнее задание
П. 70, стр. 182, задачи (1-2).