Физика - Поурочные планы к учебникам Мякишева Г. Я. и Касьянова В. А. 11 класс
Строение атома. Опыты Резерфорда - Атомная физика - Квантовая физика
Цель: познакомить учащихся с ядерной моделью атома.
Ход урока
I. Организационный момент
II. Изучение нового материала
Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомической теории рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц - атомов.
Позиция Демокрита: «Существует предел деления - атом».
Позиция Аристотеля: «Делимость вещества бесконечна».
Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. Открыли электрон, измерили его массу и заряд. Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 году, развил Л. Лоренц. Именно он создал электронную теорию: электроны входят в состав атома.
В начале века в физике бытовали самые разные и часто фантастические представления о строении атома. Например, ректор Мюнхенского университета Фердинанд Линдеман в 1905 г. утверждал, что «атом кислорода имеет форму кольца, а атом серы - форму лепешки». Продолжала жить и теория «вихревого атома» лорда Кельвина, согласно которой, атом устроен подобно кольцам дыма, выпускаемым изо рта опытным курильщиком.
Опираясь на открытия, Дж. Томсон в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10-10 м, в котором «плавают» электроны, нейтрализующие положительный заряд. Большинство физиков склонялось, что прав Дж. Томсон.
Однако в физике уже более 200 лет принято правило: окончательный выбор между гипотезами вправе сделать только опыт. Такой опыт поставил в 1909 г. Эрнест Резерфорд (1871-1937) со своими сотрудниками.
Пропуская пучок α-частиц (заряд +2е, масса 6,64 · 10-27 кг) через тонкую золотую фольгу, Э. Резерфорд обнаружил, что какая-то из частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть α-частиц отражается от фольги. Но, согласно модели атома Томсона, эти α-частицы при взаимодействии с атомами фольги должны отклоняться на малые углы, порядка 2°. Однако несложный расчет показывает: чтобы объяснить даже такие небольшие отклонения, нужно допустить, что в атомах фольги может возникать огромное электрическое поле напряженностью свыше 200 кВ/см. В полиэтиленовом шаре Томсона таких напряжений быть не может. Столкновения с электронами тоже не в счет. Ведь по сравнению с ними, α-частица, летящая со скоростью 20 км/с, все равно, что пушечное ядро с горошиной.
В поисках разгадки Резерфорд предложил Гейгеру и Марсдену проверить: «а не могут ли α-частицы отскакивать от фольги назад».
Прошло два года. За это время Гейгер и Марсден сосчитали более миллиона сцинтилляций и доказали, что назад отражается примерно одна α-частица из 8 тысяч.
Резерфорд показал, что модель Томсона находится в противоречии с его опытом. Обобщая результаты своих опытов, Резерфорд предложил ядерную (планетарную) модель строения атома:
1. Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома.
2. В ядре сконцентрирована почти вся масса атома.
3. Отрицательный заряд всех электронов распределен по всему объему атома.
Расчеты показали, что α-частицы, которые взаимодействуют с электронами в веществе, почти не отклоняются. Только некоторые α-частицы проходят вблизи ядра и испытывают резкие отклонения.
Если ![]() или потенциальная энергия системы α-частицы - ядро.
или потенциальная энергия системы α-частицы - ядро.
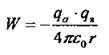
или 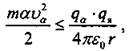 то α-частица будет отброшена назад.
то α-частица будет отброшена назад.
При расчете учитывают, что qα = 2е, где е - заряд электрона: qя = Ze; Z - зарядовое число, равное количеству электронов в атоме; диаметр ядра 10-14-10-15 м, атома 10-10 м.
Сообщение Резерфорда физики приняли сдержанно. Сам он в течение двух лет также не очень сильно настаивал на своей модели, хотя и был уверен в безошибочности опытов, которые к ней привели. Причина была следующая.
Если верить электродинамике, такая система существовать не может, поскольку электрон, вращающийся по ее законам, неизбежно и очень скоро упадет на ядро. Приходилось выбирать: либо электродинамика, либо планетарная модель атома. Физики молча выбрали первое. Молча, потому что нельзя было ни забыть, ни опровергнуть опыты Резерфорда. Физика атома зашла в тупик.
III. Закрепление материала
- В чем заключается сущность модели Томсона?
- Начертите и объясните схему опыта Резерфорда по рассеиванию α-частиц. Что наблюдаем в этом опыте?
- Объясните причину рассеивания α-частиц атомами вещества?
- В чем сущность планетарной модели атома?
IV. Подведение итогов урока
Дополнительный материал
Эрнест Резерфорд
Английский физик Эрнест Резерфорд родился в Новой Зеландии, неподалеку от г. Нельсона. Он был одним из 12 детей колесного мастера и строительного рабочего Джеймса Резерфорда, шотландца по происхождению, и Марты (Томпсон) Резерфорд, школьной учительницы из Англии. Сначала Резерфорд посещал начальную и среднюю местные школы, а затем стал стипендиатом Нельсон-колледжа, частной высшей школы, где проявил себя талантливым студентом, особенно по математике. Благодаря успехам в учебе Резерфорд получил еще одну стипендию, которая позволила ему поступить в Кентербери-колледж в Крайстчерче, одном из крупнейших городов Новой Зеландии.
В колледже на Резерфорда оказали большое влияние его учителя: преподававший физику и химию Э.У. Бикертон и математик Дж. Кук. После того как в 1892 г. Резерфорду была присуждена степень бакалавра гуманитарных наук, он остался в Кентербери-колледже и продолжил свои занятия благодаря полученной стипендии по математике. На следующий год он стал магистром гуманитарных наук, лучше всех сдав экзамены по математике и физике.
В 1894 г. Резерфорду была присуждена степень бакалавра естественных наук. Затем Резерфорд в течение недолгого времени преподавал в одной из мужских школ Крайстчерча. Благодаря своим необыкновенным способностям к науке Резерфорд был удостоен стипендии Кембриджского университета в Англии, где он занимался в Кавендишской лаборатории, одном из ведущих мировых центров научных исследований.
В Кембридже Резерфорд работал под руководством английского физика Дж. Томсона. На Томсона произвело глубокое впечатление, проведенное Резерфордом исследование радиоволн, и он в 1896 г. предложил совместно изучать воздействие рентгеновских лучей (открытых годом ранее Вильгельмом Рентгеном) на электрические разряды в газах. Их сотрудничество увенчалось весомыми результатами, включая открытие Томсоном электрона - атомной частицы, несущей отрицательный электрический заряд. Опираясь на свои исследования, Томсон и Резерфорд выдвинули предположение, что когда рентгеновские лучи проходят через газ, они разрушают атомы этого газа, высвобождая одинаковое число положительно и отрицательно заряженных частиц. Эти частицы они назвали ионами. После этой работы Резерфорд занялся изучением атомной структуры.
В 1898 г. Резерфорд принял место профессора Макгиллского университета в Монреале (Канада), где начал серию важных экспериментов, касающихся радиоактивного излучения элемента урана. Вскоре он открыл два вида этого излучения: испускание альфа-лучей, проникающих только на короткое расстояние, и бета-лучей, которые проникают на значительно большее расстояние. Затем Резерфорд обнаружил, что радиоактивный торий испускает газообразный радиоактивный продукт, который он назвал «эманация» (от лат. «emanatio» - истечение).
Кстати, за открытие альфа и бета излучения он получил Нобелевскую премию по химии. В своей речи при получении премии он язвительно сказал: «Мне приходилось иметь дело с весьма различными трансмутациями во времени, но быстрейшая из всех, какие я встречал, это мое собственное превращение из физика в химика - оно произошло в одно мгновение». Возможно это произошло из-за того, что само понятие атом принадлежало словарю и физиков и химиков, хотя ни те ни другие еще не умели его расшифровать. Однако главная его заслуга в открытии строения атома.