Физика - Поурочные планы к учебникам Мякишева Г. Я. и Касьянова В. А. 11 класс
Строение атомного ядра - Физика атомного ядра - Квантовая физика
Цель: познакомить учащихся со строением атомного ядра.
Ход урока
I. Организационный момент
II. Проверка домашнего задания. Повторение
- Расскажите об устройстве и принципе действия счетчика Гейгера.
- Для регистрации каких частиц применяется счетчик Гейгера?
- Расскажите об устройстве и принципе действия камеры Вильсона.
- Какие характеристики частиц можно определить с помощью камеры Вильсона, помещенной в магнитное поле?
- В чем преимущество пузырьковой камеры перед камерой Вильсона? Чем отличаются эти приборы?
III. Изучение нового материала
В 1911 г. в результате проведенных Резерфордом исследований по рассеиванию α-частиц при прохождении через вещество, был открыт проток (ядро атома водорода), который обладает положительным электрическим зарядом, равным модулю заряда электрона.
Заряд ядра атома
Английский физик Г. Мозин в 1913 г. предсказал, что заряд ядра атома qя > Ze, где е - элементарный электрический заряд; Z - порядковый номер элемента в таблице Менделеева, определяет число электронов в атоме. Химические свойства зависят только от зарядового числа.
Немецкие ученые В. Боте и Г. Беккер, изучая реакции, проходящие при облучении бериллия α-частицами (1930 г.), обнаружили новое излучение, обладающее очень большой проникающей способностью.
В 1932 г. английский физик Дж. Чэдвин выдвинул гипотезу: бериллиевые лучи состоят из нейтральных частиц, масса которых близка к массе протона. Их назвали нейтронами. Дальнейшие исследования показали, что нейтрон - нестабильная частица: свободный нейтрон за время 15 мин. распадается на протон, электрон и нейтрино-частицу, лишенную массы покоя. Масса нейтрона mn = 1838,6 электронных масс, масса протона - mр = 1836,1 электронных масс, mn больше mр приблизительно на 2,5 массы электрона. После открытия нейтрона 10n физики Д. Д. Иваненко и В. Г. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении ядра. По этой гипотезе число протонов в ядре Z, число нейтронов N, массовое число - это суммарное число нуклонов в ядре - А:
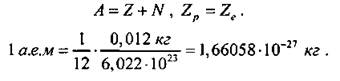
Изотопы
В 1911 г. Ф. Содди предположил, что ядра с одинаковым числом протонов, но различным числом нейтронов, являются ядрами одного и того же химического элемента. Такие ядра он назвал изотопами. Изотопы имеют одинаковые химические свойства, что обусловлено массой. Блестящее подтверждение - физический прибор массспектрометр.
Например, изотопы урана: 23592U, 23892U;
изотопы водорода: 11Н, 21Н, 31Н.
IV. Закрепление изученного материала
- Как иначе называется и каким символом обозначается ядро атома водорода?
- Каковы его масса и заряд?
- Когда впервые было выдвинуто предположение о существовании электрически нейтральных частиц с массой приблизительно равной массе протона?
- Кто и когда первый доказал, что бериллиевое излучение представляет собой поток нейтронов?
- Как было доказано отсутствие электрического заряда у нейтронов? Как он обозначается?
V. Решение задач
1. Ядром какого элемента является протон?
2. Сколько процентов составляет разность в массах покоя протона и нейтрона по отношению к массе покоя протона?
3. Сколько нуклонов содержат ядра лития 63L , меди 6429Сu, серебра 10827Ag, свинца 20782Рb?
4. Определите нуклоновый состав ядер гелия 42Не, кислорода 168O, селена 7934Se , ртути 20080Hg, радия 22688Rа, урана 23592U.
5. Доля каких нуклонов в ядрах элементов возрастает с увеличением зарядового числа?
6. Назовите химический элемент, в атомном ядре которого содержатся нуклоны:
а) 7р + 7n;
б) 18р + 22n;
в) 33р + 42n;
г) 84р + 126n.
Домашнее задание
§ 105, упр.
Р — 1172; Р — 1173.
Дополнительный материал
Шел 1910 год. То было время непрерывного изучения альфа-лучей. Эксперименты Резерфорда, начатые еще в Канаде вслед за открытием законов радиоактивности, позволили установить природу альфа-лучей. Оказалось, что это дважды ионизированные атомы гелия (голые ядра без электронных оболочек), вылетающие при радиоактивном распаде с колоссальной скоростью 10000 км/с, поскольку относительная атомная масса альфа-частиц равна 4, а заряд +2, они, как тяжелые снаряды, проникают в толщу вещества и могут кое-что «рассказать» об устройстве материи.
Резерфорда удивляло, что альфа-частицы, пронизывая мишени (обычно листки металлической фольги), отклонялись на самые разные углы. Очевидно, внутри вещества действуют мощные электрические поля: ведь только они могут искривлять траектории массивных заряженных частиц.
И вот в 1909 г. наступил тот зимний день, когда Марсден (молодой сотрудник Резерфорда по исследованиям) остановил на университетской лестнице Резерфорда и совсем буднично произнес: «Вы были правы, профессор: они возвращаются...».
«Они» возвращались редко: в среднем одна альфа-частица из восьми тысяч. Отражение от мишени означало, что альфа-частица встретила на своем пути достойную преграду - массивную и положительно заряженную, только такая может с силой оттолкнуть от себя прилетевшую гостью. Редкость события говорила о крайне малых размерах преграды. И потому немногие альфа-частицы попадают в сердцевину.
После этого события, Резерфорд, «забыв остановиться», представил в своем воображении планетарный атом: вокруг положительно заряженного ядра, как планеты вокруг Солнца, вращаются отрицательно заряженные электроны.
С осмотрительной точностью сказал тогда Резерфорд, что знает только как выглядит атом, а не как он устроен. По законам классической физики, атом не мог иметь подобного строения: вращаясь вокруг ядра, электроны должны излучать, а значит, терять энергию и неизбежно падать на ядро. В общем, Резерфорд увидел обреченный атом.
Спасение пришло в 1913 г. В Манчестере появился 28-летний датчанин Нильс Бор - тихий теоретик и дерзкий мыслитель. Он принес с собой то недостающее новое - идеи теории квантов. Планетарный атом - детище безумного эксперимента и могучей интуиции - навсегда утвердился на квантовом основании.